2018 年,首项(the first-ever)为一名 CLN7 型 Batten 病 [译者注:又名神经元蜡样脂褐质沉积症] 女孩研发的个体化(individualized)基因疗法问世 [1]。

个体化基因疗法能够在基因、转录本或变异层面精准靶向疾病的致病根源 [2]。 用于该 Batten 病患者的治疗方案为一种反义寡核苷酸(antisense oligonucleotide, ASO),可阻断由患者 CLN7 基因(即 MFSD8 基因) 的一个致病性变异引发的异常剪接。
截至目前,全球范围内已研发出 20 余种个体化 ASO 疗法,惠及超过 30 例患者,且新病例仍在持续纳入 [3] 。
值得关注的是,个体化寡核苷酸疗法的数量现已超过商业化寡核苷酸疗法,凸显出近年来该领域投入的巨大研发力量。另有研究报道了个体化基因添加(gene addition)疗法与碱基编辑疗法的相关进展[4,5], 印证了个体化治疗领域正处于高速扩张阶段。
需要强调的是,个体化疗法的研发模式与商业化药物存在本质区别。国际罕见病研究联盟(IRDiRC)的 “N-of-1 专项工作组” 已于 2024 年发布了路线图,详细阐述了研发涉及的步骤、流程及基础设施建设要点 [6]。 尽管每种特定疗法均具备个体化属性,但所有疗法的研发仍存在通用的步骤与流程框架。
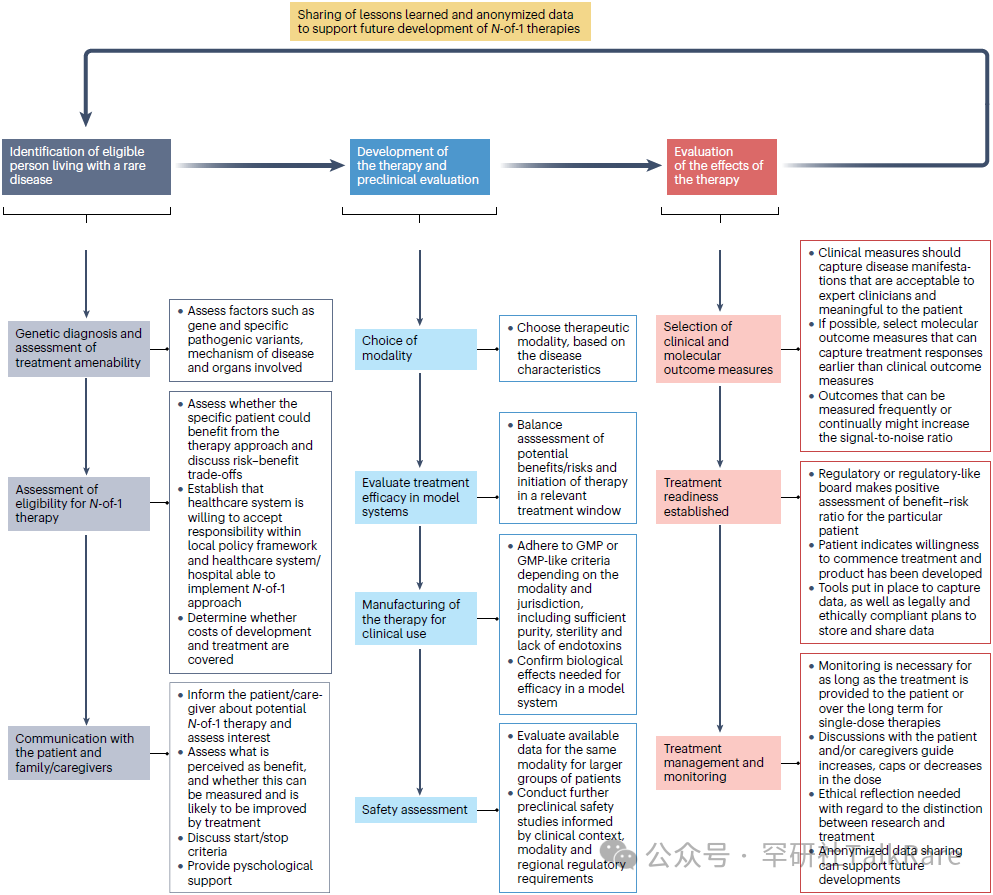
图:Roadmap for N-of-1 therapy development
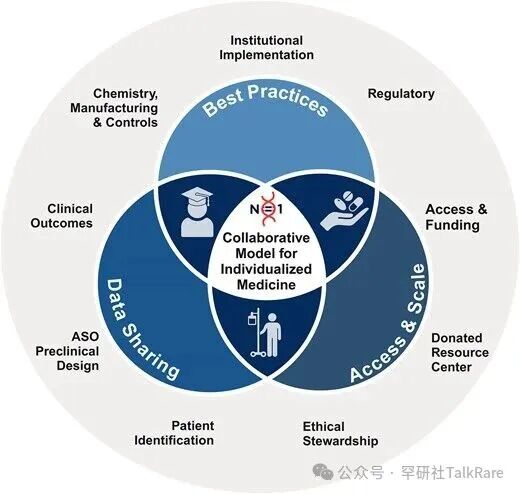
“N=1 Collaborative” 等非营利性机构致力于简化研发流程,提供标准化操作方案、框架及指南,为个体化疗法的研发人员提供支持 [3]。该联盟还整合了各类治疗研发项目(无论成败)中积累的信息与技术经验,为未来个体化疗法的研发提供优化建议与指导。目前相关指南与路线图仍在完善中,随着领域的发展,其内容也将持续细化与更新。
Ther Adv Rare Dis 本期专刊邀请多位作者分享其在个体化疗法研发全流程中的实践经验,收录的文章全面呈现了研发各阶段面临的挑战。
个体化治疗的首要环节是明确基因诊断,而这正是众多极罕见遗传病患者的诊疗短板。巴塔利亚团队 [7] 报道了一例临床病例:一名女性患者在幼儿期表现出智力障碍与小头畸形,17 岁时确诊毛母质瘤(pilomatricomas,一种罕见的良性皮肤肿瘤)。此类皮肤肿瘤仅与少数特定遗传性综合征相关,在前期分子诊断结果为阴性的情况下,研究团队通过全外显子组测序,最终发现患者EP300 基因存在致病性变异,确诊为 Rubinstein–Taybi 综合征 2 型。
弗里恩斯团队 [8] 的研究阐述了治疗方案如何根据患者的解剖学特征进行个性化调整。该团队报道了两名先天性耳聋的兄妹,两人均检出 FGF3 基因可能致病性变异,确诊为 LAMM 综合征。针对患者的耳聋症状,团队为两名男孩实施了人工脑干听觉植入术,并发现 LAMM 综合征患者存在脑干解剖结构异常。为此,研究团队对标准手术流程进行了改良,最终显著提升了患者的治疗效果。作者强调,鉴于不同遗传性综合征患者存在解剖结构差异,临床手术及相关诊疗操作均需针对性调整,以适配患者的个体特征。
要评估治疗效果,就必须为每例患者制定专属的临床疗效评价指标。米勒团队 [9] 对神经发育障碍及智力障碍临床试验中使用的疗效评价指标进行了综述。研究发现,目前该领域使用的疗效评价指标种类繁多且缺乏标准化规范。对此,作者强调建立统一通用评价指标的重要性,同时指出评价指标应聚焦于与患者密切相关的健康结局,以确保治疗能为目标患者个体及群体带来切实的临床获益。在个体化疗法的研发过程中,患者的核心地位尤为突出,应全程参与临床疗效评价指标的制定工作。
最后,荷兰 RNA 治疗中心(荷兰一家非营利性联合研究机构,致力于为罕见脑与眼部遗传病患者研发个体化 RNA 疗法)的作者团队 [10] 介绍了该中心的建设历程,阐述了团队已克服及仍面临的重重挑战,并分享了积累的经验,旨在为其他机构开展同类研究提供参考。
目前,个体化疗法研发仍面临一项关键挑战 —— 如何实现从少数个案治疗向大规模个体化治疗的跨越。这需要跨学科团队协同合作,联合监管机构、伦理学家、临床医生、科研人员及患者群体,共同推动个体化疗法的规模化发展与可持续应用 [6]。