双侧肱肌萎缩瘫痪(Brachial amyotrophic diplegia, BAD),又称连枷臂综合征(flail-arm syndrome, FAS),代表一种进展相对缓慢的运动神经元病(MND),被公认为肌萎缩侧索硬化症(ALS)的区域性变异型。此类退行性病变特征性地影响下运动神经元,症状长期局限于上肢,患者生存期通常较典型ALS更长。在罕见情况下,文献报道了一些可治疗性BAD/FAS病例,特别是以副肿瘤神经综合征(PNS)形式表现的病例,如与睾丸生殖细胞肿瘤相关的抗LUZP4/抗KLHL11抗体阳性病例,或与肺癌及抗Hu抗体相关的病例。然而,即使积极开展肿瘤治疗并辅以静脉免疫球蛋白、糖皮质激素或免疫抑制剂,这类病例的预后通常依然不甚理想。近期《Neurol Neuroimmunol Neuroinflamm》杂志报道了一例有意思的病例:患者表现为亚急性发病的BAD/FAS,同时诊断前列腺腺癌,经抗肿瘤治疗后神经系统症状获得显著改善。
本例为一名68岁男性,因上肢无力亚急性发作(症状在2周内迅速出现)被转诊至该中心ALS专科门诊。患者个人及家族史无特殊。初诊时,症状已持续约5个月,上肢功能障碍严重影响日常生活。神经系统检查发现上肢肌肉呈广泛性、轻度不对称性萎缩,双手表现出特征性分裂征(split-hand sign),呈纯运动性障碍,主要累及远端肌群。下肢、躯干及面部肌肉力量正常。上肢腱反射减弱,下肢反射亢进。未见延髓受累征象或任何感觉障碍。
电生理检查显示纯运动性轴索型神经源性损害局限于上肢,无传导阻滞。针电极肌电图检查发现上肢多个不同躯干及神经根支配的肌肉存在持续性去神经化变化(如纤颤电位、正锐波)、肌束颤动电位及慢性神经原性改变。下肢、腹直肌及颏舌肌检查均未见异常。头颅和全脊髓MRI未显示明显异常信号。血液学检查包括感染及自身免疫筛查(含肿瘤相关及抗神经节苷脂抗体)均为阴性,血铅浓度正常。运动诱发电位(MEP)提示四肢皮质脊髓束轻度受损,躯体感觉诱发电位正常。
脑脊液检查显示白细胞计数和蛋白浓度在正常范围,但存在显著的寡克隆IgG条带,且NfL水平明显升高(2028 ng/L,正常值<750)。通过组织基免疫荧光技术在患者脑脊液中检出抗Ank3 IgG自身抗体,但血清中未能检测到。

图:(A 和 B)大鼠脑切片的免疫组化染色,分别使用患者脑脊液(A)和对照脑脊液(B)。在小脑分子层的树突可以观察到强烈标记,同时也可见小脑颗粒层的标记。(C)抗体靶点通过细胞实验得到验证。仅患者脑脊液与瞬时转染有大鼠Ank3全长编码质粒的人胚肾293T细胞发生阳性反应。
与神经系统症状同期,患者出现排尿困难,并发现前列腺特异性抗原(PSA)异常升高。前列腺穿刺活检确诊为腺癌,伴髂部及腹膜后淋巴结转移(Gleason评分:10分)。病理检查未见神经内分泌分化成分。随即启动双重内分泌治疗(曲普瑞林联合阿帕鲁胺),未进行外科手术。治疗4个月后,PSA降至检测限以下,胆碱PET/CT显示代谢完全缓解。患者神经系统症状同步显著改善:激素治疗开始后,上肢无力逐渐减轻,最后随访(治疗超过2年)时,患者日常功能已完全恢复。值得注意的是,抗Ank3自身抗体在症状起始后17个月的脑脊液样本中仍持续可检出。
副肿瘤神经综合征(PNS)是一类由免疫介导的肿瘤相关神经系统疾病,常伴有特异性肿瘤相关神经元抗体,但与肿瘤直接侵犯、转移、感染、代谢障碍或医源性因素无关。判断癌症与神经系统疾病之间的因果关系往往具有挑战性;现有PNS诊断指南采用评分系统,综合考虑临床表型、肿瘤相关神经元抗体存在情况及肿瘤特征。虽然MND在现行诊断标准中未被列为PNS的"高风险"临床表型,但既往文献确有记载罕见但确凿的副肿瘤性MND病例,近期大型病例系列研究也有相关发现。这些病例与多种肿瘤类型及经典肿瘤相关神经元抗体(如抗Hu、抗CV2/CRMP5、抗Ma2)存在关联。
本病例具有多项特征支持副肿瘤性BAD/FAS的诊断:亚急性起病过程、脑脊液中的炎性改变、神经系统症状与恶性肿瘤同时发现,以及最具说服力的证据——在未采用免疫治疗的情况下,单纯抗肿瘤治疗后神经系统症状获得显著改善。这些特点强烈提示一种由肿瘤触发、针对神经系统的非变性自身免疫过程。尽管相对少见,前列腺癌相关的PNS在文献中已有报道。
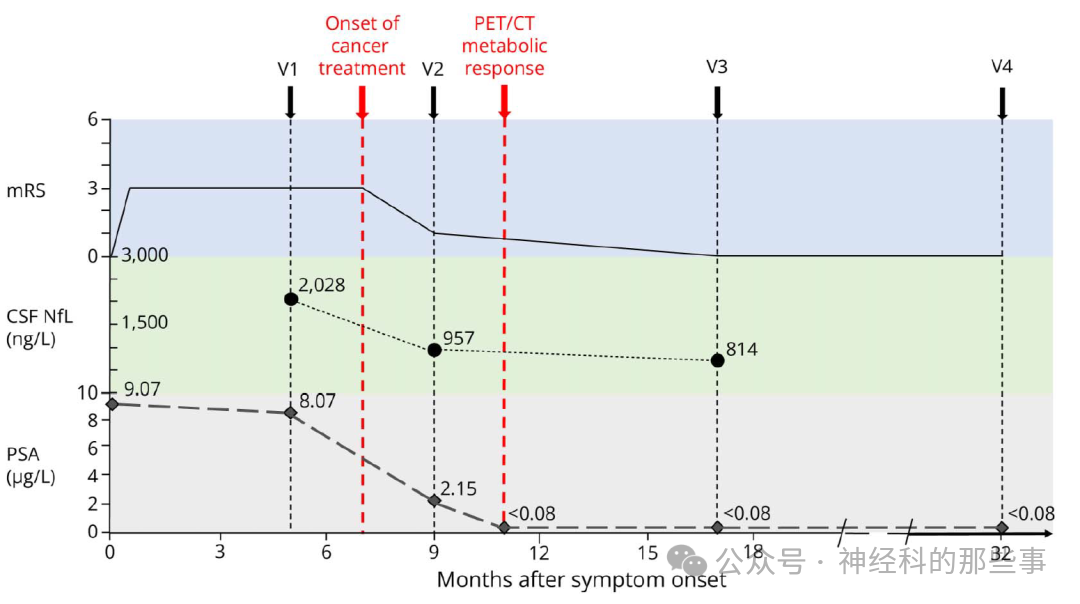
图:功能状态(mRS)及辅助检查( 脑脊液 NfL、PSA)随时间的变化,均以症状出现和肿瘤治疗开始为参照。V1 为首次就诊,V2 为第二次就诊,V3 为第三次就诊,V4 为第四次就诊于神经内科,分别为症状出现后第5、9、17和32个月。亚急性发病表现为 mRS 在大约两周内迅速升高。V1 时 mRS 为3分(中度残疾),V2 时为1分(无显著残疾,但仍存在一些症状),V3 与 V4 均为0分(无症状)。症状改善始于肿瘤治疗开始前后。脑脊液 NfL 和 PSA 水平随随访呈下降趋势。mRS = 改良 Rankin 评分量表;NfL = 神经丝轻链;PSA = 前列腺特异性抗原。
由于采用保守治疗方案,我们未能分析肿瘤组织中的抗原表达情况,也无法完全排除活检可能遗漏了神经内分泌分化成分的可能性。在鉴别诊断过程中,MRI检查已排除颈段神经根或脊髓前角的结构性病变,脑脊液分析也排除了病毒感染或癌性脑膜炎。急性运动轴索神经病(AMAN)的诊断不被支持,主要依据临床受累限于上肢、缺乏抗GM1 IgG抗体、无明确前驱感染史,以及MEP证实的锥体束受累。脊髓灰质炎相关神经病也被排除,因患者无相关病史且疫苗接种完整。最终,患者症状明显改善的临床事实不支持变性或遗传性病因。尽管如此,按照最新PNS诊断标准,本病例仍仅能归类为"可能的"PNS,这也反映现行标准可能低估了未检测到典型肿瘤相关神经元抗体的PNS发生率。
本例在患者脑脊液中检测到抗Ank3自身抗体,这一发现的临床意义尚待阐明。ANK3是锚蛋白家族成员,通过连接细胞骨架与质膜维持细胞结构稳定性。ANK3在人体中表达广泛,主要分布于神经元轴突、肌肉细胞和前列腺细胞。多项研究发现人类肿瘤中存在ANK3表达异常,但具体机制尚未完全阐明。近期研究表明,ANK3与肿瘤免疫微环境密切相关,其表达与免疫检查点分子及新生抗原表达存在关联。此外,ANK3参与调节癌细胞中雄激素受体稳定性,实验数据显示敲除ANK3可促进癌细胞侵袭能力。
在神经系统中,ANK3主要定位于轴突起始段(axon initial segment, AIS),在电压门控离子通道的锚定与空间排布中发挥关键作用。最近研究利用ALS患者诱导多能干细胞衍生的运动神经元发现,ANK3表达异常与AIS结构改变、AIS可塑性受损、神经元活动内稳态调节障碍及固有高兴奋性等病理改变相关。尽管如此,目前仍缺乏ANK3直接参与MND发病机制的确凿证据。
值得注意的是,文献中仅报道了2例抗Ank3抗体阳性病例,其临床表现(脑膜脑炎、癫痫发作)与本例完全不同,病因分别为控制良好的HIV感染和转移性卵巢癌。由于ANK3为胞内蛋白,推测抗Ank3抗体可能不具直接致病性,更可能作为抗神经元细胞自身免疫过程的标志物。然而,该抗体的确切临床意义与病理相关性仍需深入研究。在我们对344例对照样本(包括82例MND、166例PNS/自身免疫性脑炎、89例阿尔茨海默病、7例精神疾病患者)的筛查中,脑脊液中均未检出该抗体。未来需开展更多类似病例研究,并追踪抗体滴度动态变化,以深入理解其在疾病过程中的意义。
综上所述,本病例因其非典型的MND表现形式和经肿瘤治疗后显著改善的预后而具有重要价值。这一罕见案例强调,即使在缺乏经典肿瘤相关神经元抗体的情况下,MND仍可作为副肿瘤神经综合征的表现形式,且预后并非不可逆转。在评估非典型运动神经元病患者时,全面筛查潜在肿瘤具有重要临床意义,及时的抗肿瘤治疗可能改变患者的疾病轨迹和长期预后。
Paraneoplastic Brachial Amyotrophic Diplegia With Favorable Outcome and Anti-Ank3 Antibodies: A Case Report. Neurol Neuroimmunol Neuroinflamm . 2025 Nov;12(6):e200488.