僵人综合征(Stiff-person syndrome, SPS)是一种罕见的自身免疫性疾病,其临床特征主要表现为进行性肌肉僵硬,尤其影响躯干和肢体肌群,常伴有疼痛性肌肉痉挛发作(MSAs)以及显著的焦虑和抑郁症状。在病理生理机制上,GABA能抑制性神经传递功能受损被认为是核心环节,而大多数SPS患者血清中可检测到针对谷氨酸脱羧酶(GAD)的自身抗体,这一发现为该疾病的自身免疫病因提供了重要证据。
目前SPS的免疫调节治疗效果存在显著异质性,常规治疗包括静脉免疫球蛋白(IVIg)、糖皮质激素、血浆置换、利妥昔单抗及自体造血干细胞移植等,但这些方案在治疗成功率和患者耐受性方面差异显著,许多患者仍面临难治性病程。近年来,自体抗CD19嵌合抗原受体(CAR)T细胞疗法因其能深度清除B细胞并重塑免疫系统,在多种难治性自身免疫疾病中展现出可喜的治疗前景。本文报道了一例病程长达14年的难治性SPS合并重症肌无力(MG)患者,在接受CAR-T细胞治疗后实现显著临床改善并获得9个月随访数据的病例,为这一新型疗法在神经免疫疾病中的应用提供了宝贵临床经验。
该患者为62岁女性,自2010年(48岁时)首次出现双下肢疼痛性肌肉痉挛,随后被确诊为抗GAD65阳性的僵人综合征。早期曾接受硫唑嘌呤、反复静脉甲泼尼龙冲击(ivMP)及鞘内曲安奈德注射等治疗。尽管疾病过程中经历了多次症状加重与缓解,但直至2017年,患者仍能保持基本行走能力和自理能力,反映了疾病早期阶段的相对稳定状态。
然而,从2018年至2020年期间,患者的下肢僵硬症状明显进展加重,逐渐发展为双足持续性蹬地尖足畸形,严重限制了其活动能力。即使多次接受静脉甲泼尼龙和免疫球蛋白治疗,症状改善也仅为轻微且短暂。2020年末,病情进一步恶化,患者出现左侧斜方肌、三角肌及肱二头肌的持续性僵硬,伴随着难以缓解的严重疼痛性肌肉痉挛发作,显示疾病已进入难治性阶段。
2021至2022年间,患者病情急剧恶化,多次因不明原因的急性呼吸功能衰竭入住重症监护病房,最终不得不进行气管切开术。最后一次急性发作后,患者被转入作者所在医院,经进一步检查发现合并有乙酰胆碱受体抗体IgG阳性的重症肌无力。尽管联合血浆置换和利妥昔单抗治疗成功改善了MG相关症状,但SPS症状却毫无缓解。即使外周血B细胞已被耗竭,并继续联合多种免疫抑制方案(利妥昔单抗、硫唑嘌呤、口服糖皮质激素及定期IVIg),SPS症状依然持续进展并导致严重残疾。到2023年底,患者的最大步行距离仅为10-15米,左上臂完全僵硬,肩部持续被动抬高,肘部屈曲畸形,且每日可发生多达30次的疼痛性肌肉痉挛。各种对症治疗如巴氯芬、氯硝西泮、加巴喷丁及卡马西平均告无效,甚至颈肩臂丛神经阻滞也仅能带来短暂症状缓解。
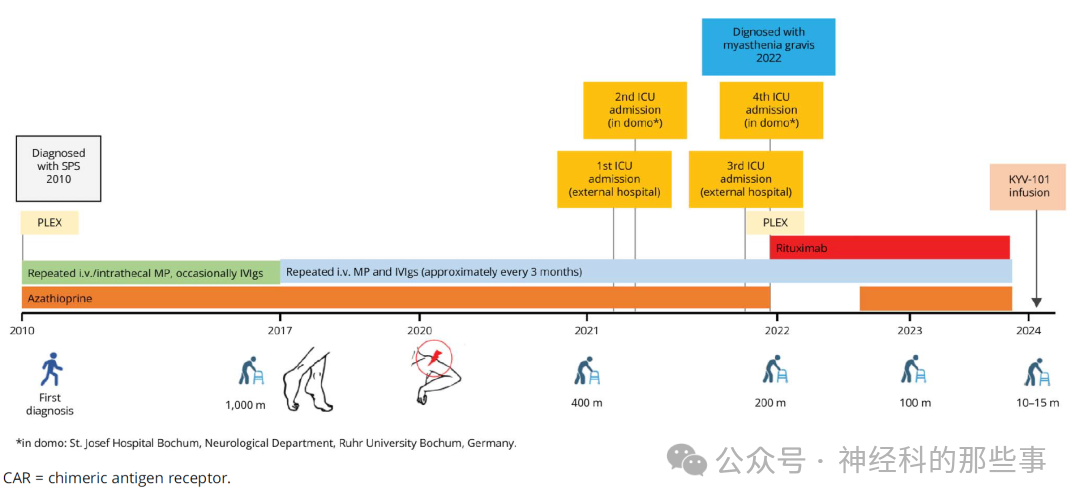
图:2010年发病至2024年接受抗CD19 CAR-T细胞治疗的疾病进程
在传统治疗方案均告失败的背景下,2024年,患者获批以人道主义用药方式接受第二代自体抗CD19 CAR-T细胞治疗(KYV-101,由Kyverna Therapeutics公司提供)。治疗前分别在第-6、-5、-4天给予氟达拉滨30 mg/m²及环磷酰胺300 mg/m²作为淋巴细胞清除预处理,随后在第0天一次性静脉输注1×10⁸个抗CD19 CAR-T细胞。通过流式细胞术监测显示,CAR-T细胞自输注后第5天起开始迅速扩增,并于第19天达到峰值(468个/μL)。与此同时,外周血B细胞被迅速彻底耗竭,证实了治疗的即刻生物学效应。
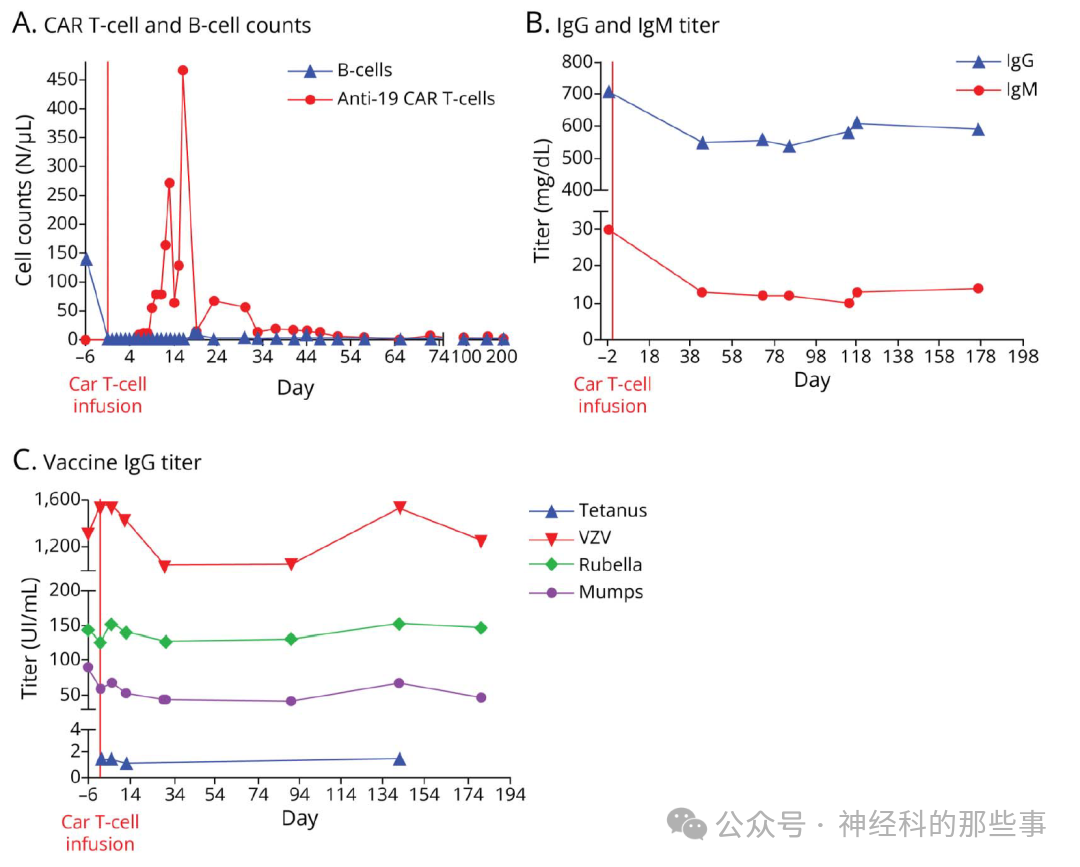
图:(A) CAR T细胞和B细胞计数,(B) IgM和IgG滴度,以及(C) 疫苗滴度(腮腺炎、风疹、水痘带状疱疹病毒[VZV]、破伤风)。CAR = 嵌合抗原受体。
安全性评估方面,患者在治疗后第6至9天出现了2级细胞因子释放综合征(CRS),表现为发热(最高体温38.2°C)及类似流感的全身症状,经对乙酰氨基酚及托珠单抗治疗后顺利缓解。第11天出现颈部肿胀伴淋巴结及腮腺增大,经地塞米松治疗后好转。整个治疗过程中,虽然因淋巴细胞清除预处理出现2级白细胞减少,但未观察到任何感染性并发症。血清IgM及IgG水平均有一定程度下降,但仍维持在无需补充治疗的范围内。值得注意的是,针对多种常见病原体(腮腺炎、带状疱疹病毒、风疹及破伤风)的保护性抗体滴度在治疗后仍维持在有效保护水平,这表明长寿命浆细胞功能得以保留。
CAR-T细胞治疗后,患者的临床改善呈现出时间依赖性特征。重症肌无力评分在治疗后第20天从4分显著降至2分,并在随后的随访中保持稳定。SPS症状的改善则相对缓慢,自治疗后第3个月开始变得明显,表现为左臂僵硬程度减轻,肩部和肘部关节活动范围增加。高度敏感量表评分从基线的4分逐渐降至第9个月的0分,疼痛性肌肉痉挛发作频率也从基线每日30次显著降低至第3-6个月时的每日10次,第9个月时进一步减少至每日仅2次。疼痛评估(painDETECT量表)同样显示从基线的25分(重度神经病理性疼痛)降至第6个月的7分(轻微疼痛)。
患者的心理状态也随疾病控制而改善。医院焦虑抑郁量表显示,尽管治疗初期焦虑和抑郁评分有轻度升高(焦虑从基线14分升至1个月时15分,抑郁从12分升至14分),但自第3个月起两项分数均开始下降,并自第6个月起稳定在7分,反映了生活质量的全面提升。患者的运动功能自第2个月起明显改善,第3个月时已能够独立行走,至第9个月随访时,最大步行距离已达到1公里。此外,患者体重减轻17公斤,体质指数从28降至21 kg/m²,回归正常范围。实验室指标方面,抗谷氨酸脱羧酶抗体滴度从1:320显著降至第9个月的1:32,而先前利妥昔单抗治疗后残留的低水平抗乙酰胆碱受体抗体(0.67 nmol/L)在CAR-T治疗后完全转为阴性。
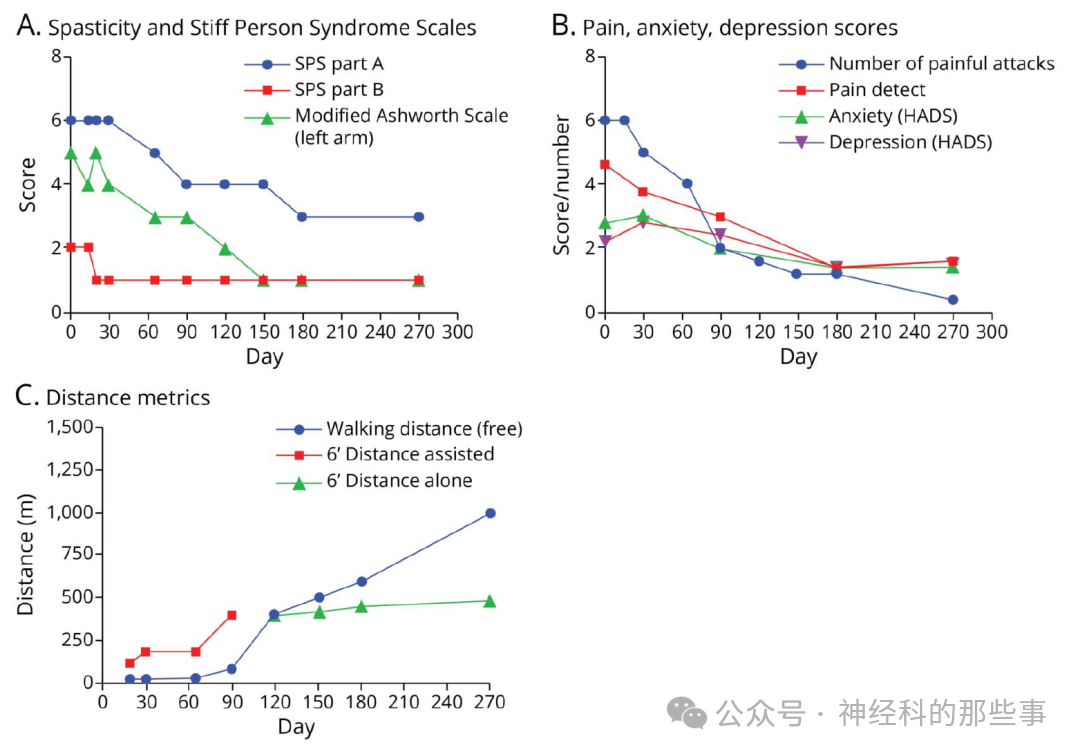
图:(A) 痉挛和僵人综合征量表(A、B部分,改良Ashworth量表);(B) 疼痛、焦虑与抑郁评分(采用HADS评分),疼痛发作次数,Pain Detect评分;以及 (C) 最大步行距离,带辅助和无辅助(自由)情况下的6分钟步行距离。CAR = 嵌合抗原受体;HADS = 医院焦虑与抑郁量表。
尽管取得显著临床改善,但患者由于长期肌肉僵硬导致的韧带缩短,肘关节仍无法完全伸直(活动范围限制在>90–100°)。对肱二头肌和肱桡肌追加的肉毒毒素注射治疗未能进一步改善这一结构性限制。值得强调的是,在整个9个月随访期间,患者未需要任何额外的免疫抑制治疗,提示CAR-T细胞治疗带来了持久的免疫重塑效应。
本病例为抗CD19 CAR-T细胞疗法在长期难治性僵人综合征治疗中的成功应用提供了重要证据。该治疗在SPS发病14年后,仍能实现症状的显著临床改善,特别是对僵硬、疼痛性肌肉痉挛和焦虑等核心症状的缓解尤为明显。从时间动态来看,这些临床改善自输注后第3个月起才变得显著,推测反映了CAR-T细胞深度免疫重塑的效应,而非仅是淋巴细胞清除预处理的短暂影响。
值得关注的是,本患者此前曾接受包括利妥昔单抗在内的多种免疫调节治疗,均未能有效控制SPS症状,这与临床试验证实的利妥昔单抗对SPS无显著疗效的结论相符。相比之下,同一患者的重症肌无力症状在利妥昔单抗治疗后得到了良好控制,这一差异反映了不同自身免疫神经系统疾病的免疫病理机制可能存在显著差异。
CAR-T细胞治疗在本例中显示出有效性的最合理解释,是其能够对CD19阳性B细胞在淋巴器官,甚至可能在中枢神经系统淋巴组织中实现更深层次、更彻底的清除,而这些组织区域往往是常规B细胞靶向单抗药物难以充分作用的部位。作者推测,治疗期间出现的颈部淋巴结肿大现象,可能正是CAR-T细胞在二级淋巴器官中大规模清除B细胞的临床表现,最终导致了B细胞的完全耗竭。虽然本例患者未进行相关检测,但有研究报道在多发性硬化患者的脑脊液中检测到KYV-101 CAR-T细胞,并证实其可影响中枢神经系统内的免疫球蛋白合成,这为理解CAR-T细胞可能直接作用于中枢神经系统免疫环境提供了支持。
SPS患者对各种免疫调节治疗的反应率普遍有限,加之随病程进展可能发生不可逆的神经元丢失,表明其病理过程可能包含可逆性功能障碍和不可逆性GABA能神经元损失两个方面,这也解释了疾病的进行性特征。本例患者与既往报道中病程9年后接受CAR-T治疗的患者类似,均未能实现完全临床恢复,这一现象强调了早期加强免疫治疗干预的重要性,以防止不可逆神经损伤的形成。
安全性方面,与既往文献报道一致,本例CAR-T治疗未见严重并发症,虽有持续性白细胞减少,但未发生感染或显著的免疫球蛋白水平下降。值得注意的是,CAR-T细胞治疗在自身免疫疾病中的耐受性显著优于其在血液系统恶性肿瘤中的应用,这可能与自身免疫疾病患者不存在大规模肿瘤细胞溶解现象有关。另一个重要发现是,各种疫苗接种后产生的保护性抗体滴度在治疗后仍维持稳定,这可能归功于长寿命CD19阴性浆细胞的持续存在,相比于自体造血干细胞移植,这代表了CAR-T细胞治疗的又一潜在优势。
总体而言,本病例报告进一步印证了CAR-T细胞治疗在多种神经免疫疾病中的应用前景,包括此前已有报道的重症肌无力、慢性炎性脱髓鞘性多发性神经根神经病以及中枢神经系统脱髓鞘性疾病等。对于难治性抗GAD抗体阳性僵人综合征患者,CAR-T细胞治疗可能代表一种有前景的治疗新选择。然而,未来仍需更大样本量的研究、更长期的随访观察以及对更早期疾病阶段进行干预的临床试验,以全面评估这一创新疗法在僵人综合征治疗中的长期安全性和有效性。
参考文献:
Anti-CD19 CAR T-Cell Therapy in Advanced Stiff-Person Syndrome and Concomitant Myasthenia Gravis. Neurol Neuroimmunol Neuroinflamm . 2025 Nov;12(6):e200479.