尽管围绕重症肌无力(MG)的发病机制和临床转归已构建了丰富的研究体系,但MG的高度异质性和不可预测的自然病程依然是临床管理中的重要挑战。近期发表在《Neurology》杂志上的一项由Oved等研究者领导的多中心、多国横断面研究,通过分析AChR抗体阳性MG患者的亚单位特异性免疫优势与临床特征关系,提供了该疾病的新见解,为临床分型和精准医疗提供了依据。
研究采用了多国多中心的横断面设计。所有纳入样本均需符合以下条件:临床上确诊为MG,并通过两项独立实验室检测(放射免疫分析和ELISA)确认AChR-IgG抗体阳性(≥0.5 nM)。样本既包括以色列Rabin医学中心的前瞻性入组患者,也包括希腊、法国、乌克兰等国权威生物样本库的归档血清。最终,初筛获得599例MG AChR+样本,经排除血清抗体滴度未达标准或技术分析失败者,最终纳入513例患者。这一样本库由两个亚队列构成:一是232例拥有完整临床资料的I组,另281例仅有基线变量(年龄、性别、抗体滴度)的II组。患者中女性占50.5%,总体中位年龄为64岁(范围14–98.5岁),分布于11个国家,以法国(51.1%)和希腊(33.1%)为主。232例中获得了疾病发病年龄数据,根据50岁分界分为早发组(EOMG, <50岁,38.6%)和晚发组(LOMG, ≥50岁,61.4%);女性以早发型为主(73%),男性则以晚发型为主(69%);女性平均病程7.5年,男性为4.6年。
所有纳入样本均检测了总AChR-IgG滴度和亚单位特异性抗体滴度,并通过流式细胞术分离分析亚单位免疫优势(immunodominance)。本研究提出免疫优势可通过抗α、β、γ、δ以及ε亚单位各自的抗体比例加以区分。总体患者中位抗AChR抗体滴度为10.69 nM,分布不均呈对数正态趋势。亚单位分布中,针对α、β、γ、δ和ε的特异性抗体平均分别占总抗体的28%、13%、32%、13%、和7%,其中α和γ的免疫优势最显著。
疾病严重度主要通过MGFA评分分级,185例获得了随访时实时分级,发现20%归为中到重度(III-V级),历史最重分级可用于190例,其中59.5%经历过中重度病程。145例获得了胸腺组织学资料,38例(26.2%)胸腺增生,39例(26.9%)胸腺瘤,且两者未见重叠。研究还区分了患者在采血当下与既往最严重期的MGFA分级,进一步关注抗体滴度与疾病严重性在动态过程中的关联性。
最关键的发现在于,AChR抗体滴度与MGFA严重度呈显著正相关(Spearman ρ=0.31,p<0.0001),且该相关性独立存在于男女两性(男性ρ=0.31,p=0.0016;女性ρ=0.25,p=0.02)。女性抗体滴度显著高于男性,中位数差异近7 nM(p<0.0001),并且女性抗体滴度随年龄增长下降(p=0.0347),男性无此趋势。进一步分析发现,在疾病严重度分级中女性所占比例随着分级升高而上升,表明高严重度人群以女性为主,尤其以年轻女性为主,提示她们可能具有更高的重型MG风险。综合滴度与历史和实时MGFA严重度进行分组后发现,持续处于高严重度病程者中女性所占比例远高于男性(32% vs 11%),女性患高严重型MG的相对风险为男性的三倍。
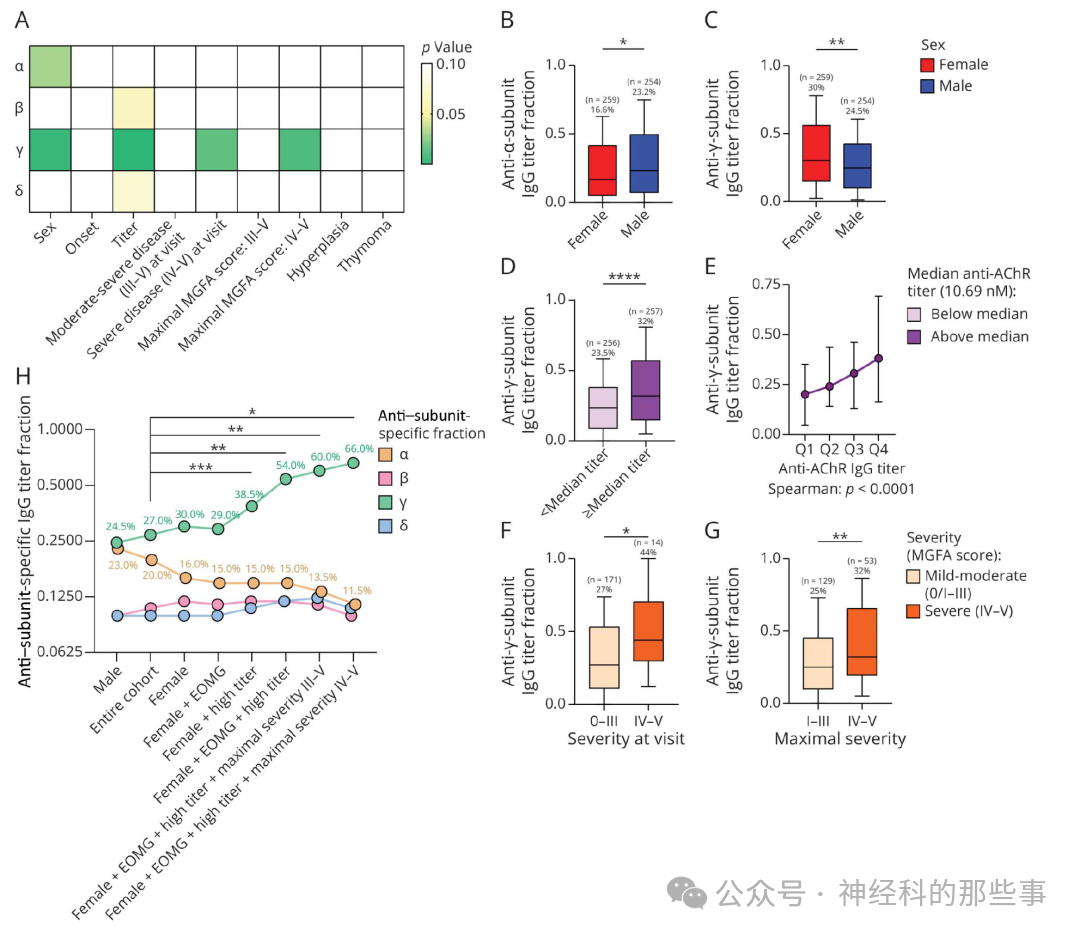
图:(A) 显著性矩阵显示针对不同AChR亚基的自身抗体免疫优势在根据临床特征分组的患者之间的潜在差异的p值。Y轴表示不同的AChR亚基。X轴表示进行比较的临床特征:性别,男性对女性;发病类型,EOMG(早发型重症肌无力)对LOMG(晚发型重症肌无力);抗体滴度,<中位数对≥中位数;就诊时病情中重度,MGFA分级0–II对III–V;就诊时重度,MGFA分级0–III对IV–V;最大MGFA分级III–V,I–II对III–V;最大MGFA分级IV–V,I–III对IV–V;胸腺增生,有对无;胸腺瘤,有对无。比较采用Mann-Whitney检验。显著性比较(p<0.05)以绿色表示,边缘显著性比较(0.05≤p<0.1)以黄色表示,非显著性比较(p≥0.1)以白色表示。(B和C) 箱线图显示男性和女性在α(B)和γ(C)AChR亚基特异性滴度分数的中位值差异。(D) 箱线图显示滴度较低(<队列中位数)与较高(≥队列中位数)患者中γ亚基特异性滴度分数的差异。(E) 以前述分析基础上,按抗AChR IgG滴度四分位进一步分层。圆点代表中位值,须状线表示四分位范围。(F和G) 箱线图显示在就诊时轻中度(MGFA评分0/I–III)与重度(MGFA评分IV–V)患者间(F)以及最大历史病情分值时(G)γ亚基特异性滴度分数的差异。(B–D,F和G) 所有箱线图均显示中位值,箱体表示四分位范围,须状线表示10%–90%百分位数。统计显著性采用Mann-Whitney U检验。(H) 图表显示具有不同累积临床特征的患者亚组的抗亚基特异性IgG滴度分数中位值。
胸腺病变与MG表型之间也呈现出重要关联。胸腺增生的患者以年轻女性为主(89.5%),且全部见于EOMG,无LOMG患者出现此病理类型。相比之下,胸腺瘤在性别和发病年龄上无显著聚集倾向,分布于EOMG和LOMG患者。整体看,胸腺增生与高IgG滴度和高严重度相关,而胸腺瘤患者抗体滴度相对较低。
亚单位特异性免疫优势分析显示,男性更易为α亚单位主导型(23.2% vs 16.6%,p=0.031),女性则以γ亚单位主导型为主(30% vs 24.5%,p=0.0027)。且γ免疫优势与高AChR抗体滴度(Spearman ρ=0.25,p<0.0001)、高疾病严重度(MGFA IV-V级患者占比44% vs 27%,p=0.0141)显著相关。进一步的无监督主成分分析(PCA)结合层次聚类揭示了两个彼此不同的免疫/临床内表型(endotype):A型以女性、EOMG、γ免疫优势、高抗体滴度和胸腺增生为特征,B型则多为男性、LOMG、α免疫优势、低抗体滴度。这一模型不仅清晰界定了MG的性别和免疫学异质性,而且为依托精细亚型指导个体化治疗提供了一定基础。进一步对B型进行细分,发现又可分为γ免疫主导的晚发女性中重度亚群,α免疫主导的晚发男性亚群,以及混合型的胸腺瘤相关亚群。
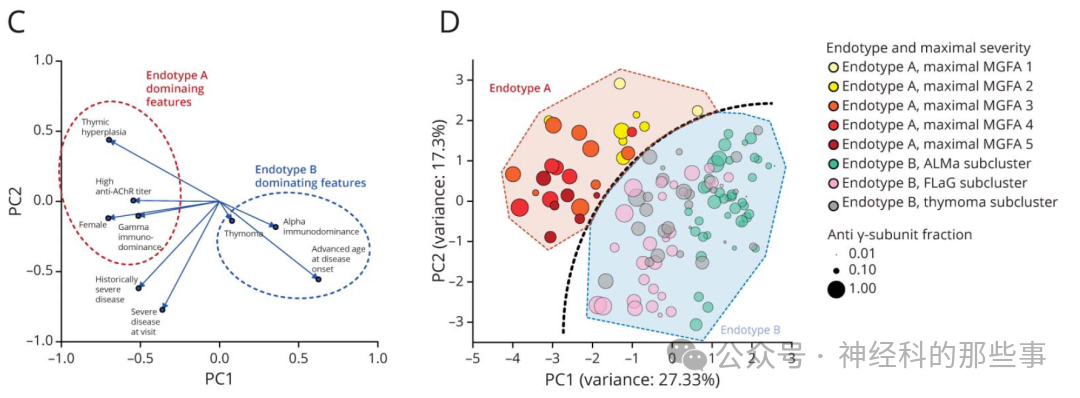
图:(C)特征向量分布显示特征聚类,提示存在2个不同的MG亚组:内表型A(棕色)和内表型B(蓝色)。(D) 主成分分析(PCA)散点图展示了经过转换的患者数据。虚线表示内表型A与内表型B之间的分界线,分别用半透明的棕色和蓝色多边形进行阴影处理。每个圆圈代表一名患者。对于内表型A,圆圈颜色从浅黄色到深红色,表示MGFA最大严重程度评分的升高。对于内表型B,圆圈颜色反映子簇归属(粉色:FLaG;青绿色:ALMa;灰色:与胸腺瘤相关)。圆圈的大小表示γ-亚基特异性抗体分数的大小。
值得注意的是,经典文献多将MG的病情异质性归因于激素、遗传、微环境等因素,尚无如本研究这样规模化实证地揭示抗体免疫优势与疾病表型的高度吻合。特别是γ免疫优势与女性、年轻、胸腺增生和重症型的交互耦合,提示了生殖期女性特殊的免疫耐受与疾病易感性,推测可能存在胎儿型AChR的免疫记忆影响、慢性NMJ损伤导致的γ亚单位补偿性表达上调、或女性生育史相关等机制。尽管这些假说尚待更多前瞻性实验佐证,但为理解MG复杂病理机制打开了新视角。
必须指出本研究的诸多局限性。首先,由于部分样本仅有基线收集资料,严密的临床特征分析未能涵盖全部患者。其次,治疗史等干预因素未统一纳入,可能对抗体滴度和疾病演变造成混杂影响。此外,MGFA评分与患者自报生活质量(MG-ADL)数据未能同步获取,也使严重度表型可能有一定偏差。最后,样本多中心、不同国家和时间段可能存在不可控治疗策略差异,但通过双队列基线变量对比显示,其基本结构具有较好的一致性,支持主要分析结论的稳定性。
综上,本研究首次以大规模样本量精确描述了AChR+ MG的临床和免疫优势亚型特征,提出了两个病理机制与临床表现紧密耦合的疾病内表型,并指出了女性高γ免疫优势和胸腺增生在严重型MG中的重要作用,这将为未来MG的分层治疗、靶向研发以及个体化健康管理提供理论基础和循证依据。
Subunit-Specific Immunodominance in Clinically Distinct Populations With AChR+ Myasthenia Gravis: A Multiparametric Cross-Sectional Analysis. Neurology. 2025 Oct;105(8):e214150.