周五Dyne Therapeutics公布了其用于治疗肌强,直性营养不良1型(DM1)的RNA药物早期研究结果。虽然核心数据显示出积极疗效,但由于一项关键生物标志物的异常数据,截止收盘股价下跌31.15%。
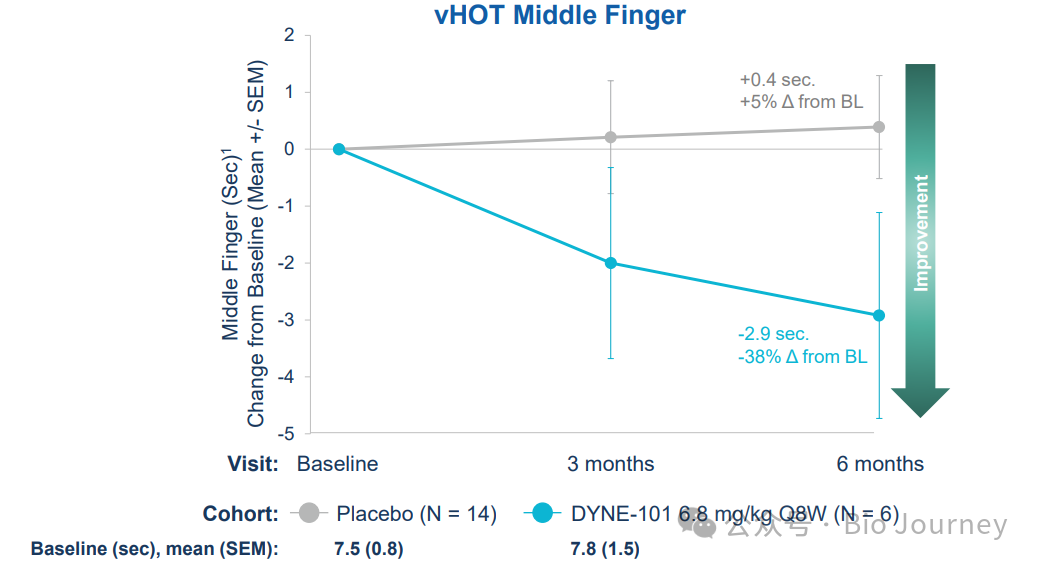
✅ 在接受DYNE-101(剂量6.8 mg/kg,每8周一次)治疗的6名患者中,观察到肌强直症状得到"早期且持续的改善"。与14名安慰剂组患者相比,治疗组在手部张开测试(vHOT)中表现明显更好,治疗组vHOT 改善了 -2.9 秒,而 14 名患者的安慰剂组则显示了 +0.4 秒的变化
✅ 患者在其他功能性指标上也显示出临床获益,包括"五次起坐测试"(Five Times Sit to Stand Test)、"10米步行测试"(10-Meter Walk Test)、定量肌力测试 (QMT)、肌肉力量和疲劳测试等。
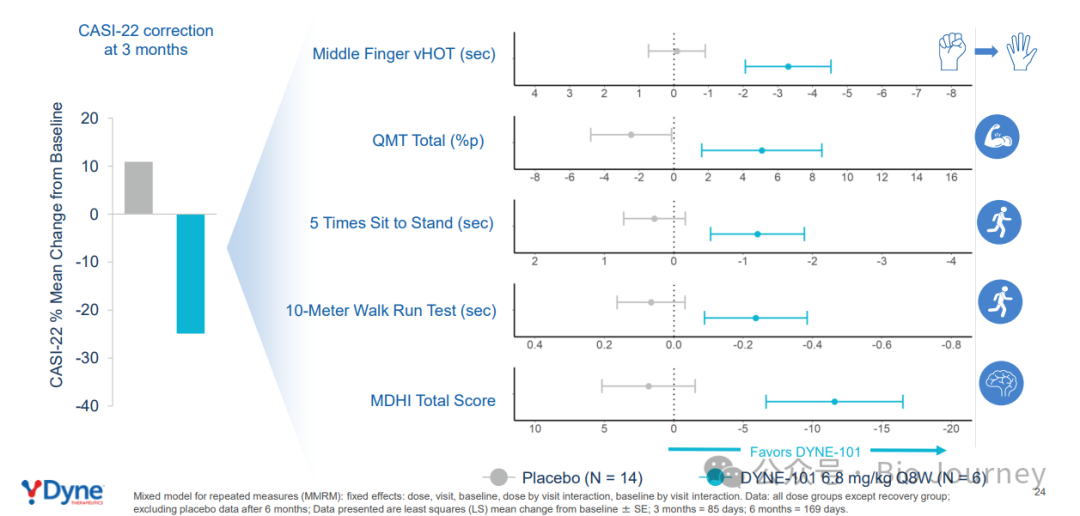
❓ 引发市场担忧的是一项名为CASI-22的剪接修正指标数据:
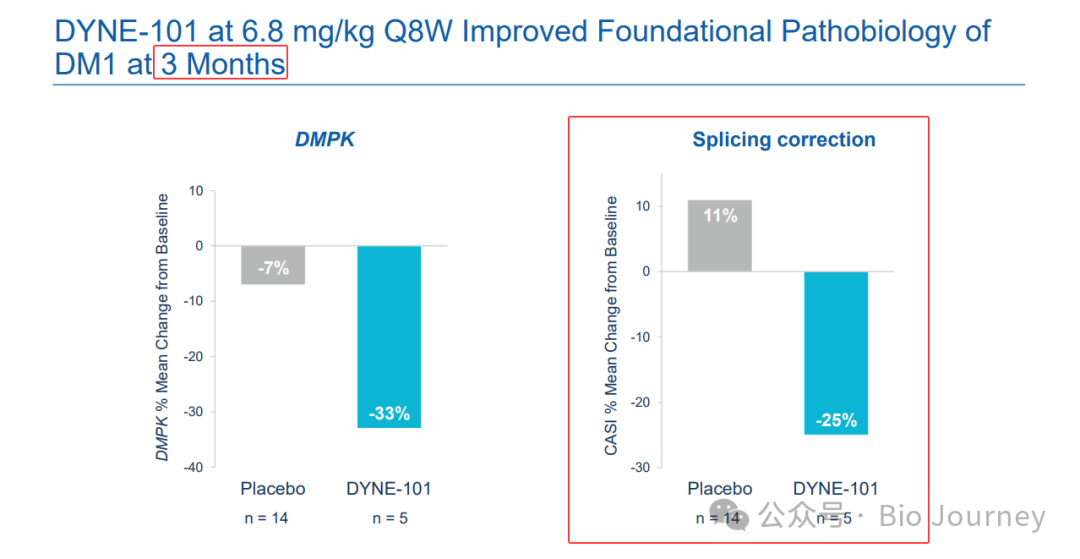
在另一个最高剂量组(5.4 mg/kg)中,3、6 和 11 个月时剪接基线的平均变化在 -23% 和 -27% 之间。
对此,Dyne CEO John Cox解释称,6个月数据点明显是一个"异常值",与DMPK基因敲降结果及功能性改善的整体趋势不符。
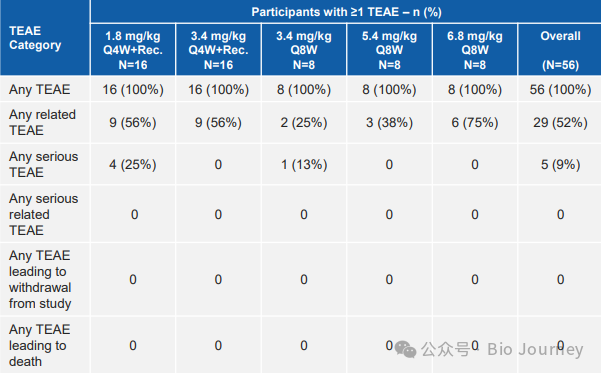
通过 ACHIEVE 试验 6.8 mg/kg Q8W 队列入组的 56 名患者的安全性和耐受性数据。 DYNE-101 表现出良好的安全性。大多数治疗中出现的不良事件是轻度或中度,尚未发现相关的严重治疗中出现的不良事件。大约已给出855剂次治疗,代表超过72个患者年的随访时间,其中一些患者的随访时间长达2.1年。
���� DYNE-101是一种创新性的反义寡核苷酸药物,通过与抗体片段结合,可以降低突变DMPK RNA水平并修正剪接过程,有望帮助肌肉细胞产生正常蛋白质。
���� 公司计划:
海外分析师预测,该药物的市场潜力可能超过30亿美元。
值得注意的是,Avidity Biosciences (RNA) 也在开发同类RNA药物,计划明年提交批准申请。
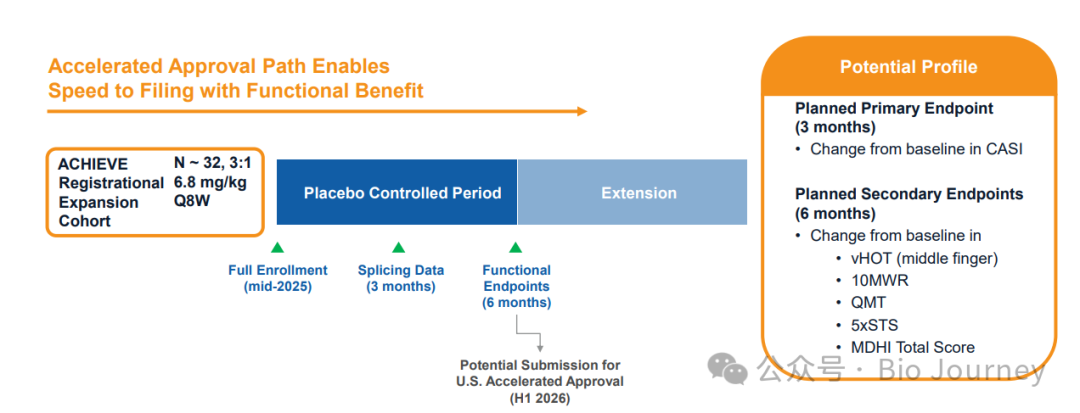
外显子 51 DMD 中的 DYNE-251 在54名患者参加的 DELIVER 研究:根据 FDA 最近的反馈,以肌营养不良蛋白作为替代终点,寻求美国加速批准;来自正在进行的 DELIVER 试验注册扩展队列的数据预计将于 2025 年末提供,有可能支持 2026 年初的监管提交
一项随机、安慰剂对照、双盲 1/2 期临床试验,采用多剂量递增 (MAD) 部分设计,旨在评估 DYNE-101 在 DM1 中的安全性和有效性。该研究旨在评估静脉注射 DYNE-101 的安全性、耐受性、药代动力学、药效学和功效。该研究方案还允许创建注册扩展队列以支持提交美国加速审批。使用DMPK和复合选择性剪接指数 (CASI-22) 等关键生物标志物评估 DYNE-101 的活性。试验中还评估了肌强直、肌肉力量、定时功能测试和患者报告的结果,包括中枢神经系统相关的疾病表现。 CASI-22 用于评估剪接校正作为替代终点的效用,并支持注册扩展队列的剂量选择。
2、手部张开测试(vulnacular Hand Opening Test, vHOT)