āshibio公司前不久宣布其ANDECAL研究的首位参与者完成用药,这是一项2/3期临床试验,评估andecaliximab在进行性骨化性纤维发育不良(fibrodysplasia ossificans progressiva,FOP)患者中的安全性、有效性、药代动力学(PK)和药效学(PD)。andecaliximab是āshibio的主要候选产品,其剂量里程碑标志着该公司在一系列以异位骨化(HO)为特征的适应症中的首次临床试验取得了进展,异位骨化是一种导致肌肉、肌腱和韧带等软组织骨形成异常的病理状况。
āshibio首席执行官Pankaj Bhargava博士说:“异位骨化是一种破坏性疾病,存在大量未满足需求。我们正在启动对进行性骨化性纤维发育不良的药物开发,这是一种罕见的遗传性疾病,其特征是严重和进行性骨化导致严重残疾和寿命缩短。FOP患者缺乏足够的治疗选择,ANDECAL试验的首位参与者用药是我们满足他们需求使命中的一个重要里程碑。Andecaliximab拥有强大的安全数据。我们的团队致力于推进这种潜在的HO创新治疗,从FOP开始,扩展到其他形式的非遗传HO。”
Andecaliximab是一种人源化抗体,可特异性抑制基质金属蛋白酶-9(MMP-9)酶,研究人员已将其确定为FOP的潜在新治疗靶点。MMP-9酶可以作为FOP新靶点的发现于2024年2月首次发表在《骨与矿物质研究杂志》(JBMR)上。
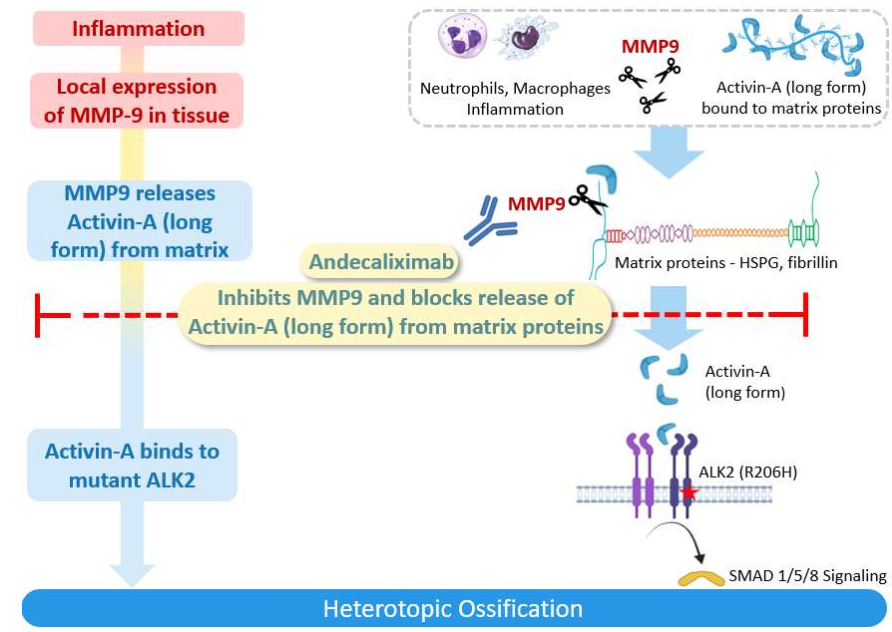
研究人员评估了一位独特的患者,他携带FOP的经典突变,但症状很轻。这位现年36岁的患者携带MMP-9基因的两个突变,这可能会保护他免受大多数FOP患者所面临的毁灭性异位骨化。在FOP小鼠模型中证实了阻断MMP-9的作用,其中敲除实验和靶向MMP-9的药物治疗显示HO显著减少。
“这位独特的患者揭示了一些可能会显著改变FOP患者生活的东西,”该研究的资深作者之一、宾夕法尼亚大学Isaac和Rose Nassau骨科分子医学教授Frederick S.Kaplan博士说,“我们希望正在进行的努力将验证我们的发现,并为FOP患者提供高质量的治疗途径。”
美国食品和药物管理局(FDA)已授予Andecaliximab儿科罕见病资格认定(RPDD),用于治疗FOP。RPDD授予美国患者人数少于20万,主要影响18岁以下人群的严重或危及生命的罕见疾病的潜在治疗方法。
原文标题:
āshibio Doses First Patient in ANDECAL study, a Phase 2/3 Trial of Andecaliximab for Treatment of Fibrodysplasia Ossificans Progressiva (FOP)