阵发性睡眠性血红蛋白尿症(PNH)是一种罕见的慢性克隆性造血干细胞疾病,其发病机理中,补体系统的异常激活扮演着至关重要的角色。zilucoplan是一种新型的C5抑制剂,这种小分子(3.5kDa)的15氨基酸大环肽以高亲和力和特异性结合C5,展现出了独特的药理特性。因此,研究人员开展两项为期12周的II期研究(研究201,NCT03078582;研究203,NCT03030183)和一项长期扩展研究(NCT03225287)中,以评估zilucoplan在PNH成年患者中的疗效、药代动力学、安全性和耐受性。
研究201(2017年4月-2018年1月)和研究203(2017年9月-2018年2月)分别入组了26名和3名PNH患者,主要终点是血清乳酸脱氢酶(LDH)水平从基线变化的情况。
这项分析包括10名未接受过依库珠单抗治疗的患者(依库珠单抗初治组)和19名曾接受过依库珠单抗治疗的患者(依库珠单抗转换组)(如图1B)。且10名未接受过依库珠单抗治疗的患者均进入扩展研究,其中2名(20.0%)患者中断治疗。在转换组中,19名患者中有8名(42.1%)中断治疗,11名(57.9%)进入扩展研究。
在治疗开始的第一天,所有患者均接受单次负荷剂量0.3 mg/kg的zilucoplan皮下注射。随后,患者在家中自行每日注射皮下zilucoplan,持续12周。若在第2周时,患者的LDH水平未能降至正常上限的1.5倍以下,或出现明显的溶血突破事件(由研究者判断),则可酌情将每日剂量增加至0.3 mg/kg。经过观察,依库珠单抗初治组的10名患者和转换组的16名患者,分别在中位时间19天(范围15-669天)和19.5天(范围1-57天)后,将剂量增加至0.3 mg/kg。
为了确保药效学研究的准确性,研究人员在给予第一剂zilucoplan后的1小时内,以及给药后的第1、3和6小时收集了血样。对于剂量增加至0.3 mg/kg的患者,在新剂量前后,其计划就诊时,均收集了用于药效学研究的样本。值得一提的是,两项研究的患者均全程参与,未出现失访情况。
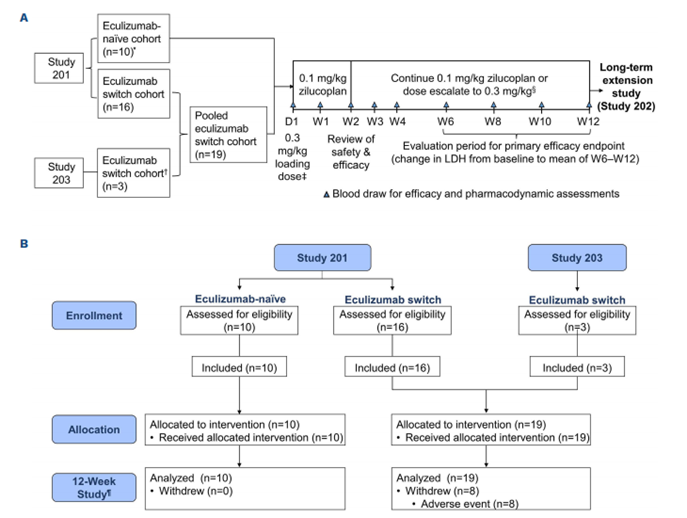 图1:研究设计
图1:研究设计
在依库珠单抗初治组中,zilucoplan治疗展现出了对经典和替代补体通路的一致、完全且持续的抑制效果(图2A)。这一抑制导致了从基线水平开始的迅速、显著且持续的LDH降低,中位LDH水平降至378.0 U/L(正常上限的1.6倍,即234 U/L)(图2B)。
值得注意的是,在需要输血的5名患者中,有2名(40%)在zilucoplan治疗后完全停止了输血需求(图2C)。此外,zilucoplan治疗还导致了所有基线后时间点游离血红蛋白的持续降低(中位变化范围:-3.90至-5.95 mg/dL)。
对于其他次要终点,包括总胆红素、总血红蛋白、结合珠蛋白、网织红细胞和血红蛋白尿,从基线到各个后续时间点的变化幅度较小或呈现不确定性,未在该患者组中呈现出明确的趋势。
在转换组中,zilucoplan治疗同样实现了经典和替代补体通路的完全且持续抑制(图3A)。然而,在治疗的主要评估期间,转换组患者的LDH中位值相较于基线增加了230.3 U/L(图3B)。进一步分析显示,在不需要输血的患者中,LDH水平在最初有所上升后于第6周达到峰值,之后稳定维持在约1.5倍正常上限的水平(图3B)。
相比之下,需要输血的患者基线LDH平均值明显高于不需要输血的患者,并且在zilucoplan治疗期间仍呈现上升趋势,在第20周达到峰值(924.7 U/L)(图3B)。同时,在转换组中需要输血的12名患者中,有4名(包括一些治疗时间不到6个月的患者)在接受zilucoplan治疗后也停止了输血(图3C)。
此外,zilucoplan的给药方式极为简便,患者仅需在家中通过皮下注射小剂量(少于1mL)即可完成,整体耐受性表现良好。在最初的12周研究期间,所有患者(n=29)均经历了不良事件,其中11例(37.9%)与治疗相关(最常见的不良事件包括头痛、溶血、头晕、疲劳和注射部位淤青)。
值得一提的是,研究期间未观察到血栓事件。此外,依库珠单抗初治组中发生与治疗相关不良事件的患者比例(20.0%)低于转换组(47.4%)。在长期扩展研究中,所有患者均经历了不良事件,其中4例(21.1%)与治疗相关。
总体而言,zilucoplan在PNH患者的治疗中展现出了良好的效果和耐受性,为这一罕见疾病提供了新的治疗选择。
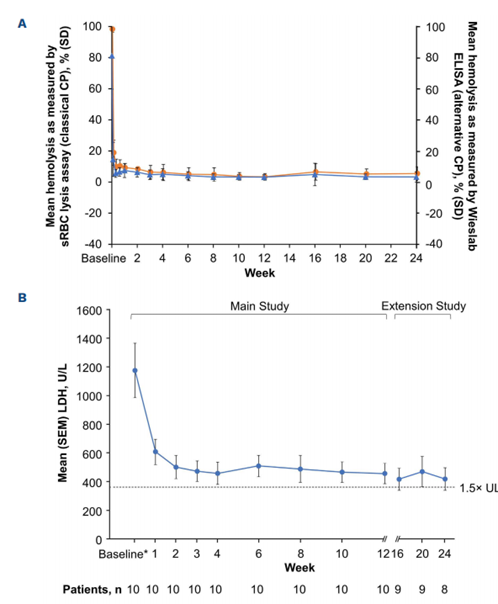 图2A、B:在依库珠单抗初治队列中,zilucoplan对PNH患者的疗效。
图2A、B:在依库珠单抗初治队列中,zilucoplan对PNH患者的疗效。
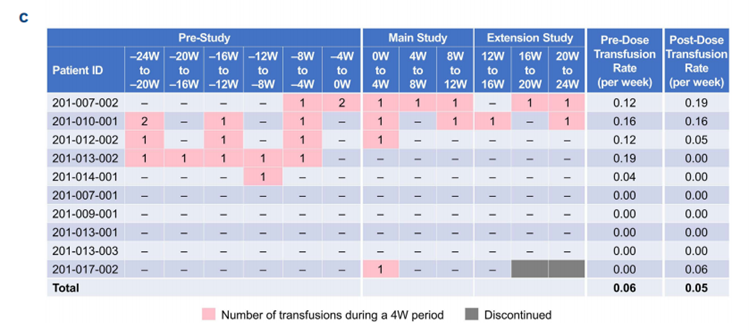
图2C:在依库珠单抗初治队列中,zilucoplan对PNH患者的疗效。
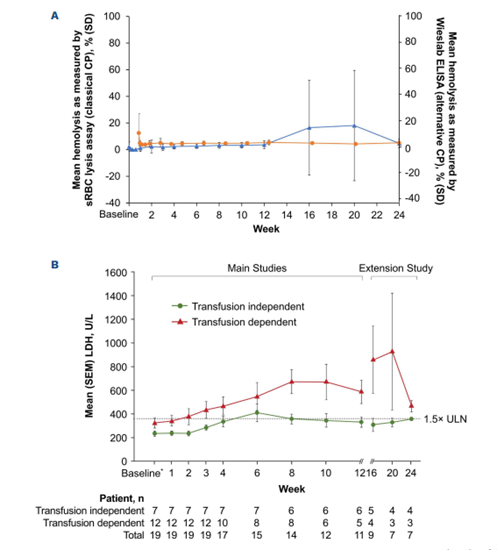
图3A、B:zilucoplan对依库珠单抗转换队列中PNH患者的疗效

图3C:zilucoplan对依库珠单抗转换队列中PMH症患者的疗效
为探究转换治疗失败的原因,研究人员利用流式细胞术分析了PNH红细胞在补体激活和C3b调理后的溶血保护效果。实验显示,在缺乏补体激活的条件下,III型红细胞占PNH红细胞池的60%,且其上检测到低水平C3b,而I型红细胞上未检测到。补体活性血清的酸化导致III型红细胞裂解,尤其在缺乏C5抑制时更为明显。
研究分析显示,依库珠单抗和zilucoplan能部分保护PNH的III型红细胞免受裂解,并减少C3b沉积。两药联合使用时,保护效果更佳,产生更多C3b高度调理的III型红细胞。推测两药组合导致III型红细胞上C3b高密度积累,而I型红细胞上未见此现象。
高浓度C3b可能非酶促裂解红细胞表面C5,这一过程不受zilucoplan等C5抑制剂影响。先前研究指出,高密度膜结合C3b可直接激活C5,形成膜攻击复合物,无需C5水解。这种构象激活无法被单一C5抑制剂抑制。
据推测,依库珠单抗洗脱后,C3密集调理的红细胞结合C5,形成zilucoplan难以抑制的C5b类似构象,导致血管内溶血。PNH治疗需确保补体终末成分完全且持续抑制。游离C5残余增加溶血风险,但本研究显示补体受完全抑制。初治依库珠单抗后转用zilucoplan的PNH患者,LDH降低与依库珠单抗效果相似,但部分高输血需求、网织红细胞计数高者对zilucoplan反应不佳。
总得来说,该分析解释了依库珠单抗转zilucoplan治疗时,PNH患者血管内溶血增加是源于PNH患者红细胞上补体抑制剂的缺失。尽管zilucoplan在PNH的临床开发已终止,但其作为新型C5抑制剂在全身性重症肌无力中展现出的有效性和安全性,以及每日皮下注射的便捷性,使其成为C5抑制剂治疗的新选择。
值得一提的是,有研究表明,联合治疗补体级联的不同组分,或能克服C5抑制剂治疗PNH时的残余溶血现象。因此,PNH未来的治疗策略或将更趋多元化和个性化。
参考文献:
[1]Kulasekararaj A G, Lehtinen A E, Forsyth C, et al. Phase II trials of zilucoplan in paroxysmal nocturnal hemoglobinuria[J]. Haematologica, 2024, 109(3): 929.