近日,士泽生物医药(苏州)有限公司(以下简称“士泽生物”)的人异体通用“现货型”神经前体细胞注射液(“XS-228注射液”)IND 申请获得国家药监局受理。
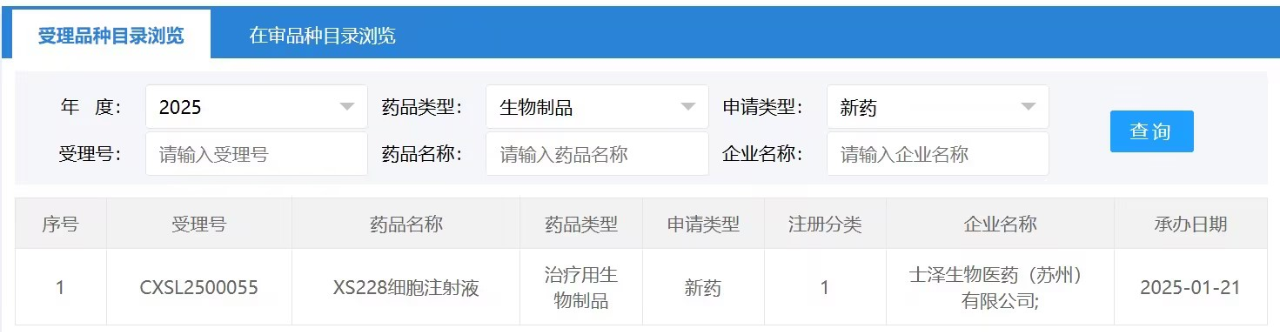
据公开信息,该候选药物拟治疗的适应症是被称为全球五大绝症之首的运动神经元疾病——渐冻症,渐冻症又名肌萎缩侧索硬化症(ALS),著名社会活动“冰桶挑战”源于渐冻症绝症患者的家庭和支持者。
此前,士泽生物另一款人异体通用“现货型”中脑多巴胺能神经前体细胞注射液(“XS-411注射液”)IND 申请获得国家药监局受理。据了解,该候选药物的适应症是帕金森病。
期待士泽生物两款已获 IND 受理的干细胞新药早日造福众多帕金森病患者及渐冻症患者!
据公开信息,此前,士泽生物已于2024年成功实施由国家两委局正式批准开展的我国全部两项临床级 iPSC 衍生细胞治疗神经系统疾病的国家级干细胞备案临床研究项目,用于治疗帕金森病及渐冻症,其中包括士泽生物已完成的全中国首例 iPS 衍生细胞治疗帕金森病、及全世界首例 iPS 衍生细胞治疗渐冻症。
目前,士泽生物与合作医院已成功开展的国家级备案临床研究中,临床级iPSC衍生细胞治疗中重度帕金森病最长随访期已达12个月,无细胞疗法相关不良事件出现,且多例患者开关期时间及MDS-UPDRS评分量表等关键疗效指标及多项非运动指标均有显著性改善趋势。士泽生物已开展的人体临床研究的积极结果,为后续进一步开展临床试验提供了重要的铺垫和关键的验证。
渐冻症,即肌萎缩侧索硬化症(ALS),是一种运动神经元病及进行性神经退行性疾病,渐冻症患者俗称渐冻人。渐冻症患者的运动神经元持续退行性病变和死亡,导致患者出现上、下运动神经元合并受损,最终可导致瘫痪,从无法行走到无法说话、吞咽、呼吸。渐冻症被称为全球五大绝症之首,临床数据显示,渐冻症患者的平均存活期约39个月,目前尚无能够实质性缓解或挽救渐冻症的有效临床药物及临床解决方案。因此,迫切需要开发新的治疗方案。
此前士泽生物自主开发的临床级 iPSC 衍生亚型神经前体细胞新药(FIC)用于治疗渐冻症,已获批开展国家级备案临床研究,此次进一步获国家药监局新药 IND 受理,士泽生物该全球创新性产品已于 2023 年获得美国食品药品监督管理局(FDA)认证授予全球孤儿药(Orphan Drug Designation,ODD)资格:为首个中国自主 iPSC 衍生细胞药获得 FDA 认证并授予孤儿药资格、也是迄今为止全球首个用于治疗渐冻症的拥有孤儿药资格的 iPSC 衍生细胞药物。士泽生物的重要研发及临床进展,代表我国在开发临床级 iPS 衍生细胞新药治疗渐冻症为代表的神经系统疾病方向处于全球领先地位。
