2024 年 12 月 12 日,辉大基因 RNA 编辑疗法 HG204 临床前研究成果在 Nature 子刊Nature Neuroscience上发表,论文题目为An RNA editing strategy rescues gene duplication in a mouse model of MECP2 duplication syndrome and nonhuman primates。研究提出了一种基于 RNA 编辑的新策略——高保真 Cas13Y (hfCas13Y)系统,该技术通过靶向降解MECP2 mRNA,成功降低其表达水平,在小鼠和非人灵长类动物中取得了显著的治疗效果。这一突破为 MECP2 重复综合征(MECP2 Duplication Syndrome,MDS)等基因剂量失衡疾病的治疗提供了全新的解决方案。
目前,RNA 编辑疗法 HG204 临床试验 HERO 已在北京大学第一医院正式启动,并完成了首例患者的给药(临床试验相关信息,请参见:辉大基因RNA编辑疗法HG204完成首例MECP2重复综合征患者给药)。
MDS 是一种由 Xq28 染色体区段重复导致的遗传病,其发病机制在于MECP2基因剂量的增加。该基因编码的 MeCP2 蛋白是一个重要的表观遗传调控因子,高表达于神经元,过量的 MeCP2 会干扰神经网络的正常功能。
临床上,MDS 主要表现为以下特征:
-运动和认知障碍: 包括婴儿期低张力、严重智力发育迟缓和癫痫;
-行为问题: 焦虑和自闭症样行为;
-高死亡率: 约 50%的患者在 25 岁前因反复呼吸道感染等并发症去世。
尽管现有治疗手段(如对症治疗和抗癫痫药物)可以部分缓解症状,但由于疾病的根本原因——MECP2过量表达未被解决,其疗效有限,对患者和家庭造成巨大负担。
在该研究中,研究团队开发了一种基于 CRISPR 的 RNA 靶向编辑技术,利用高保真 Cas13Y (hfCas13Y)对过量的 MECP2 mRNA进行选择性降解,从而降低其蛋白表达。与传统的 DNA 编辑工具(如 CRISPR-Cas9)不同,RNA 编辑不会永久改变基因组序列,从而降低潜在的脱靶效应和安全隐患。
研究人员通过筛选 10 种靶向 MECP2 的向导 RNA(gRNA),最终选择效率最高的组合(g9+3),使 MECP2 mRNA 在不同细胞系中的平均敲低效率达 71.14-97.42%。相较于 hfCas13Y v1,新筛选出的 hfCas13Y v3 在降低 MECP2 表达时具备更高效率、更低脱靶效应,并在全转录组分析中未显示显著副作用。
递送系统: 将 hfCas13Y-gMECP2 包装到 AAV-PHP.eB 载体中,通过脑室内注射(ICV)递送至 MECP2 转基因小鼠脑部。
效果验证:
a.基因表达: ICV 注射 4 周后,RT-qPCR 和免疫荧光结果显示,治疗组小鼠皮层、纹状体和海马区域的 MECP2 mRNA 表达降低至接近正常水平。
b.行为改善: 治疗后 8 周和 16 周进行的一系列行为测试结果显示,MECP2 转基因小鼠的运动、探索行为、焦虑和社交行为缺陷均得到改善。例如,在加速旋转杆测试中,给药后的 MECP2 转基因小鼠从旋转杆上跌落的潜伏期明显缩短。
c.生存期有延长趋势: 治疗组小鼠的中位生存期从 156.5 天延长至 204 天,然而,寿命延长的趋势无统计学差异。
鉴于 AAV9 载体在中枢神经系统递送中的广泛应用,研究进一步使用 AAV9 递送 hfCas13Y v3-gMECP2 至 MDS 小鼠大脑中,评估其治疗潜力。
在注射后 4 周,皮层、纹状体和海马区域的 MECP2 mRNA 及蛋白水平随剂量增加显著下降。最高剂量组(4.5 × 10¹⁰ vg)在皮质和纹状体区均实现了 MECP2 表达的正常化。
a. 加速旋转测试表明,与对照组相比,接受任一剂量治疗的小鼠从旋转杆上跌落的潜伏期都有所缩短,提示,MDS 小鼠运动能力有所改善。
b. 旷场测试测量的探索行为,治疗组无显著变化。
c. 接受两组最高剂量治疗小鼠的焦虑样行为显著改善。
s. 在社交行为测试中,最高剂量组小鼠的缺陷得到显著改善。
最高剂量组小鼠的中位生存期从 156.5 天延长至 226 天,差异具有统计学意义(P < 0.001)。
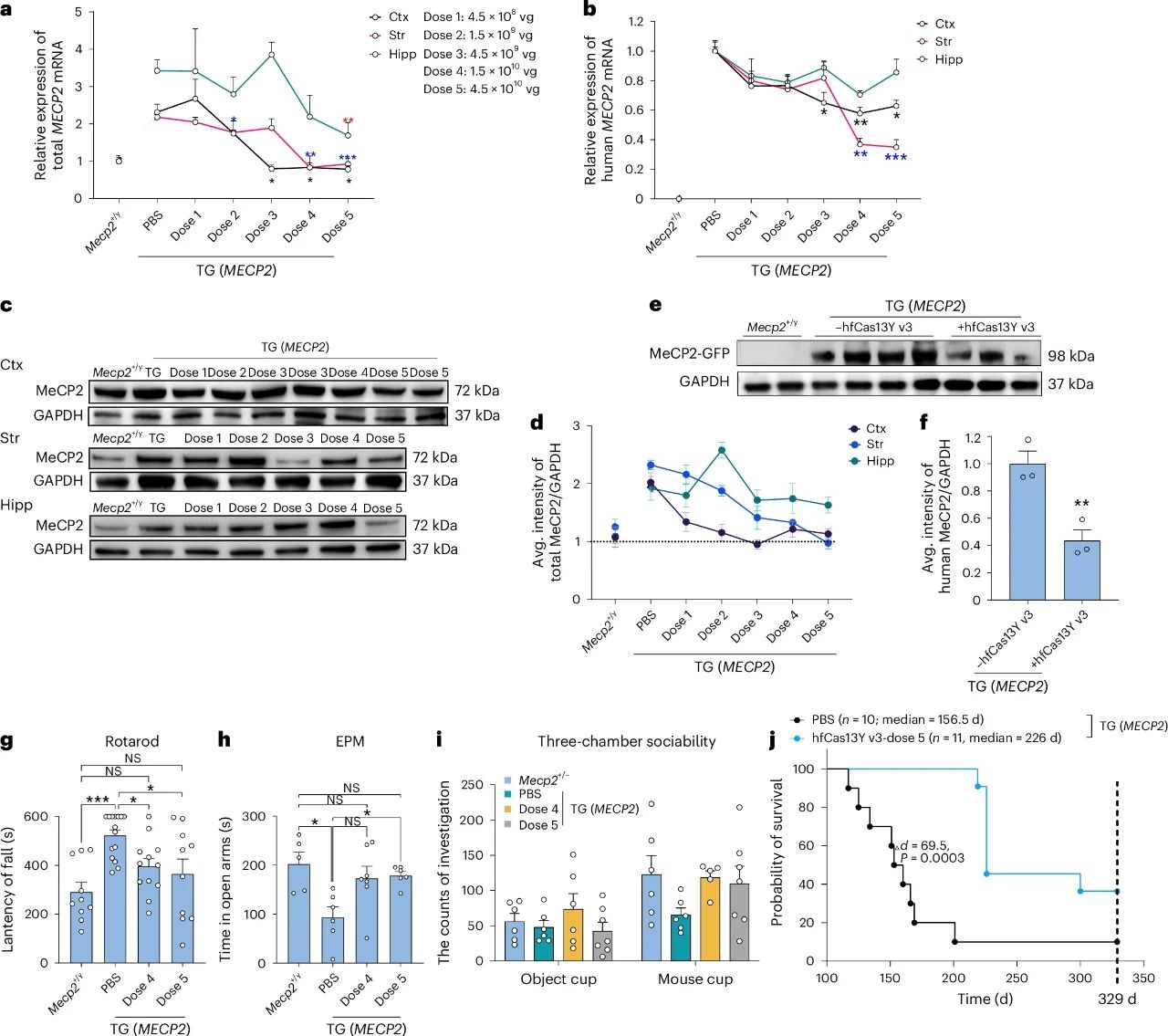
通过免疫荧光和单细胞转录组分析,研究进一步确认了 AAV9-hfCas13Y-gMECP2 对皮层单个神经元的 MECP2 敲低效果。治疗后,小鼠皮层中表达 70%-150%正常 MECP2 水平的神经元比例从 36.7%增加至 58.3% ,而 MECP2 超量表达(>150%正常水平)的神经元比例从 62.5%降至 34.8%。只有 6.9%的神经元 MECP2 表达水平低于正常水平的 70%。
a. 基因表达: 治疗 26 周后,MECP2 转基因小鼠皮层中的 MeCP2 蛋白水平维持在正常范围内(野生型水平)。
b. 组织损伤: 脑组织未观察到免疫反应或炎症。
c. 安全性指标: 治疗 48 周后,几种组织损伤生物标志物的血清水平正常,包括 ALT、AST 和 BUN,小鼠的大脑、脊髓、肝脏和肾脏未见组织损伤。
通过 ICV 注射用 AAV9-hfCas13Y-gMECP2 治疗8 周龄的雄性 MECP2 转基因小鼠,治疗后 4 周,可检测到 hfCas13Y 和 MECP2 gRNA 在皮层、纹状体和海马中广泛表达,MeCP2 蛋白水平略有下降。治疗后 8 周,MECP2 转基因小鼠的集中异常行为表型得到改善,包括跌倒潜伏期延长、探索行为和焦虑行为。然而,在用 AAV9-hfCas13Y-gMECP2 治疗16 周龄的 MECP2 转基因小鼠中,没有观察到受损社交行为的显著改善。
在 NHP 中,使用三种不同剂量的 AAV9-hfCas13Y-gMECP2 进行 ICV 注射,只在最高剂量组(1.0 × 10¹⁴ vg)中,检测到大脑皮层的 MECP2 的表达显著下降,这提示高剂量的 AAV 是抑制靶基因所必需的。
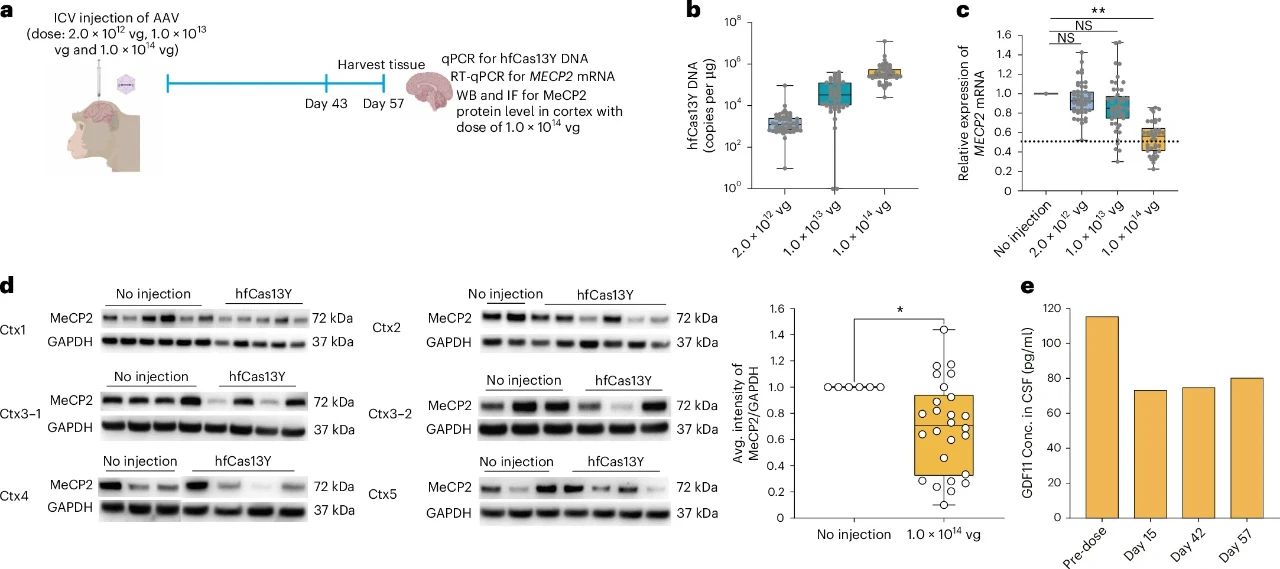
图 通过 ICV 注射 AAV9 介导的 hfCas13Y v3 递送降低了WT 雄性食蟹猴大脑中的MECP2水平(来源见后)
生长分化因子 11(GDF11)是 TGFβ 超家族的一种分泌型配体,它受到附近增强子 MeCP2 介导的组蛋白甲基化的调控。在过表达 Mecp2 的小鼠模型中,Gdf11 表达显著增加,而在 Mecp2 缺失的小鼠中表达减少。注射 AAV9-hfCas13Y-gMECP2 后第 15 天,脑脊液中的 GDF11 水平也降低至注射前基线的 63.41%,在第 57 天,仍保持在相似水平。
该研究的发现表明,通过 AAV9-hfCas13Y-gMECP2 治疗,稳定表达hfCas13Y 和 MECP2 gRNA 能够显著敲低人源化 MECP2 TG 小鼠的 MECP2 水平,改善与 MECP2 过表达相关的神经行为缺陷。免疫荧光(IF)和实时定量 PCR(qPCR)结果证实了AAV9-hfCas13Y-gMECP2 能够有效靶向 MDS 的病理改变区域。此外,还证明了 hfCas13 能够在非人灵长类动物中有效敲低MECP2 mRNA 和蛋白水平。
目前,尚缺乏针对 MDS 病理机制的基因编辑治疗方法,而该研究提供了有力的证据支持 AAV9-hfCas13Y-gMECP2 作为一种 CRISPR RNA 编辑治疗手段的潜力,显示其能够成为一种安全有效的“一次性治愈”疗法,用于治疗 MDS。
1、敲低效率的异质性: 在接受最高剂量的 AAV9-hfCas13Y-gMECP2 治疗的 MECP2 转基因小鼠皮层中,不同神经元的 MECP2 敲低效率差异较大,可能主要与 AAV9 在脑室内注射后的转导效率不一致有关。
2、死亡率问题: 尽管治疗显著延长了中位生存期,但约 60%的治疗小鼠在一年内未能存活。这可能与某些神经元中 MECP2 敲低不足或某些脑区敲低过低有关。
3、治疗的不可逆性: 当前的 AAV9-hfCas13Y-gMECP2 治疗方案为不可逆。如果发生毒性或过度矫正,无法逆转。为了在未来的临床实验中规避毒性或过度矫正的风险,应该在 NHPs 中进一步研究确定 AAV 的最佳剂量。此外,对 Cas13 介导的 MeCP2 基因敲低进行诱导控制可能是对 MDS 患者进行可逆性干预的另一种选择。