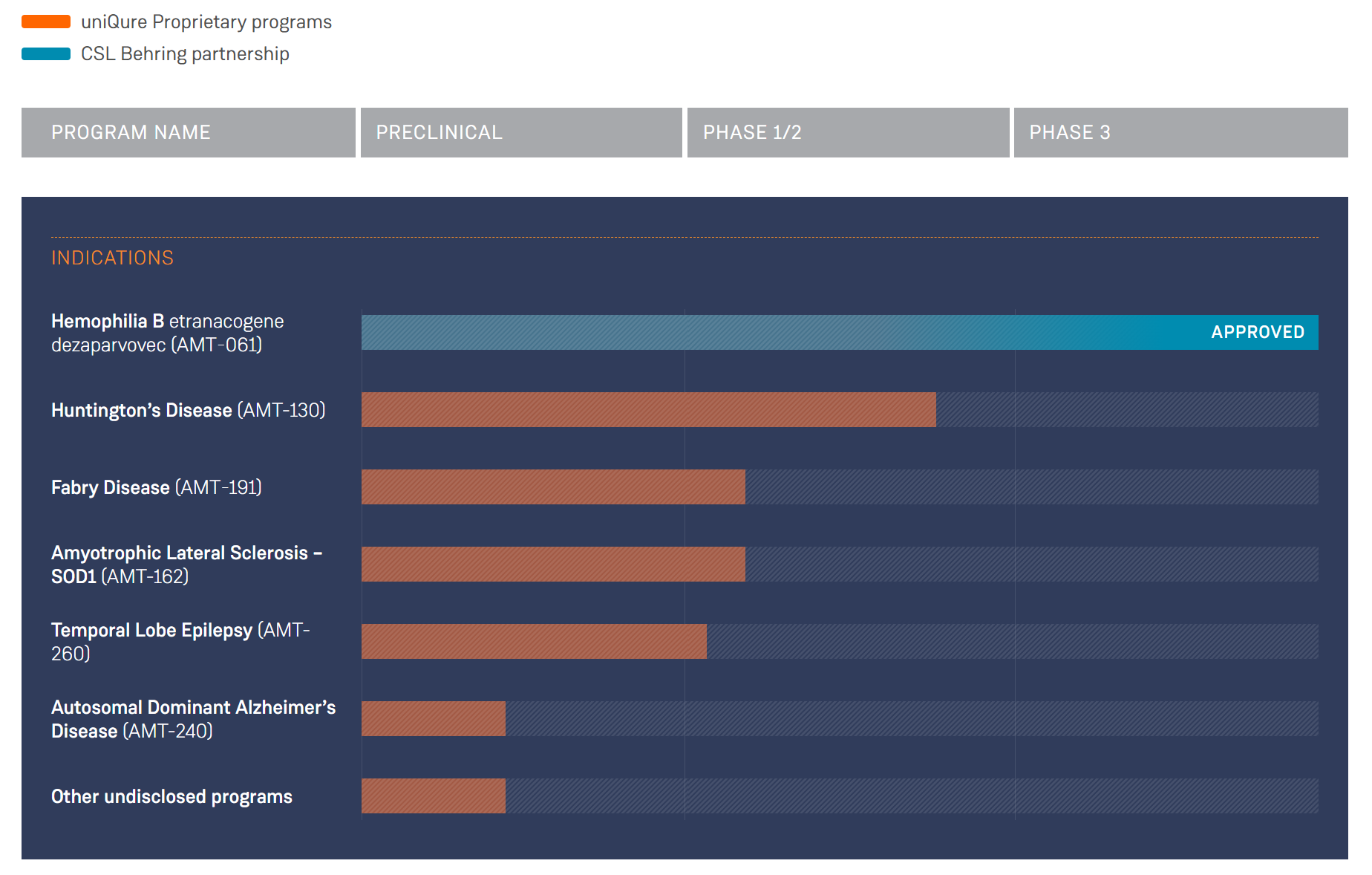
总部位于荷兰的 UniQure 周二股$QURE价上涨了120% 以上,此前该公司透露,它与 FDA “一致”,对其实验性亨廷顿病药物使用加速审批途径。
据该公司称,FDA 对使用正在进行的 1/2 期研究的数据持开放态度,该研究将 uniQure 的治疗与自然病程对照进行比较,作为加速批准的基础。这些试验使用一种称为综合统一亨廷顿病评定量表的指标作为中间临床终点,该终点被认为有合理的可能性可以预测该药物的临床益处。
UniQure 的更新是在 FDA 领导人评论该机构将在加速批准罕见病治疗方面更加灵活。
“FDA 非常开放、透明、协作,对计划和数据进行了教育,”uniQure 首席执行官 Matt Kapusta 在接受 Endpoints News 采访时说。“我们很高兴有一条清晰而明确的路径尽快向前推进。”
Kapusta 表示,其用于治疗 AMT-130 的生物制品许可申请的时间尚不清楚。该公司表示将在今年上半年提供更新,并在 8 月裁员约 65% 以减缓现金消耗。
Kapusta 表示,在接下来的 12 个月里,该公司将专注于技术制造要求,并向 FDA 提供统计分析计划,该计划将生成支持 BLA 申请的数据包。
Kapusta 说,将生产 AMT-130 的制造工厂已经是 FDA 许可的工厂,并补充说它还生产 Hemgenix,这是其与 CSL 合作的 B 型血友病基因疗法。
“这是我们与 FDA 讨论的一个关键领域:鉴于 CMC 已经参与的工作重叠,加快 CMC 准备工作的可能性,”他说。该公司在与 Kapusta 面谈后澄清说,尚未与 FDA 讨论 CMC 制剂。
Kapusta 表示,这一消息表明 FDA 愿意,“尤其是在 CBER”,如果这意味着更快地为患者提供罕见病疗法,则愿意保持灵活性。他说,在其他了解生物学的遗传病病例中,当获得传统证据具有挑战性时,FDA 应该灵活地确定终点。
关于Uniqure
Uniqure于1998年在荷兰阿姆斯特丹成立,2014年5月在纳斯达克上市,公司有全职员工220人,分布于阿姆斯特丹,荷兰的Lexington,以及美国Massachusetts,CEO是Matthew Kapusta。公司致力于使用基因治疗的方法,一次性治愈罕见病,如血友病A和B,亨廷顿舞蹈症等。公司有过基因治疗药物上市成功的先例,拥有欧洲上市的首个基因疗法Glybera,用于治疗脂蛋白脂酶缺乏症(LPLD),后因市场因素,未继续上市使用。公司有AAV5为基础的基因治疗技术平台和可商业化的基因治疗药物生产工厂。