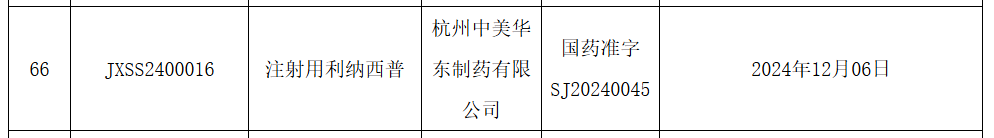
12 月 10 日,药监局官网显示,华东医药注射用利纳西普(Rilonacept)获批新适应症,用于治疗成人和 12 岁及以上青少年复发性心包炎(RP)以及降低复发风险。

复发性心包炎(RP)是指心包炎症状在4~6周无症状期后因心包反复发炎而复发,是一种会导致患者不断衰弱的罕见心脏疾病。研究显示,在急性心包炎初次发作后,约15%~30%的患者可能会复发,多达50%的患者可能经历不止一次的复发,尤其是曾接受糖皮质激素治疗的患者。据报道,美国RP发病率为 6/10万/人年,患病率为11.2/10万。我国尚无确切流行病学数据,但RP已被纳入《第二批罕见病目录》中。
心包炎复发最常见的原因是对首次发作心包炎的治疗不充分,导致白细胞介素1(IL-1)介导的自身炎症持续循环,主要表现为反复的剧烈胸痛(咳嗽或深呼吸时加重,坐直或身体前倾时可改善)、心包积液、呼吸困难等,不仅会耗占大量的医疗保健资源,还会对患者的身体功能、生活质量及工作效率等产生严重影响。
这是利纳西普在国内获批上市的第 2 项适应症,上个月该药物已获批用于治疗成人和 12 岁及以上青少年冷吡啉相关周期性综合征(CAPS),包括家族性寒冷性自身炎症综合征(FCAS)和 Muckle-Wells 综合征(MWS)。
注射用利纳西普为中美华东与美国上市公司Kiniksa Pharmaceuticals, Ltd.(Nasdaq: KNSA,以下简称“Kiniksa”)合作开发的产品,中美华东拥有该产品在中国、韩国、澳大利亚、新西兰、印度等24个亚太国家和地区(不含日本)的独家许可,包括开发、注册及商业化权益。
注射用利纳西普是重组二聚体融合蛋白,可阻断白细胞介素-1α(IL-1α)和白细胞介素-1β(IL-1β)的信号传导。该产品最早由Regeneron Pharmaceuticals, Inc.研发,于2008年获得美国食品药品监督管理局(Food and Drug Administration,简称“FDA”)批准,商品名为ARCALYST®,用于治疗冷吡啉相关周期性综合征(CAPS),包括家族性寒冷性自身炎症综合征(FCAS)和Muckle-Wells综合征(MWS)。2020年,FDA批准其用于治疗IL-1受体拮抗剂缺乏症(DIRA)。
2017年,Kiniksa从Regeneron获得了注射用利纳西普的许可。Kiniksa开发该产品用于治疗复发性心包炎(RP),这是一种自身炎症性的心血管疾病,主要症状表现为胸痛。2019年,该产品RP适应症获得FDA突破性疗法认定;2020年,该产品RP适应症获得FDA孤儿药认定,同年获得欧盟委员会授予的孤儿药认定。2021年3月,该产品RP适应症获得FDA批准上市,是目前FDA批准的第一款也是唯一一款适用于12岁及以上人群的治疗复发性心包炎药物。根据Kiniksa披露的数据,ARCALYST®2023年度净收入为2.33亿美元,2024年前三季度净收入为2.94亿美元。