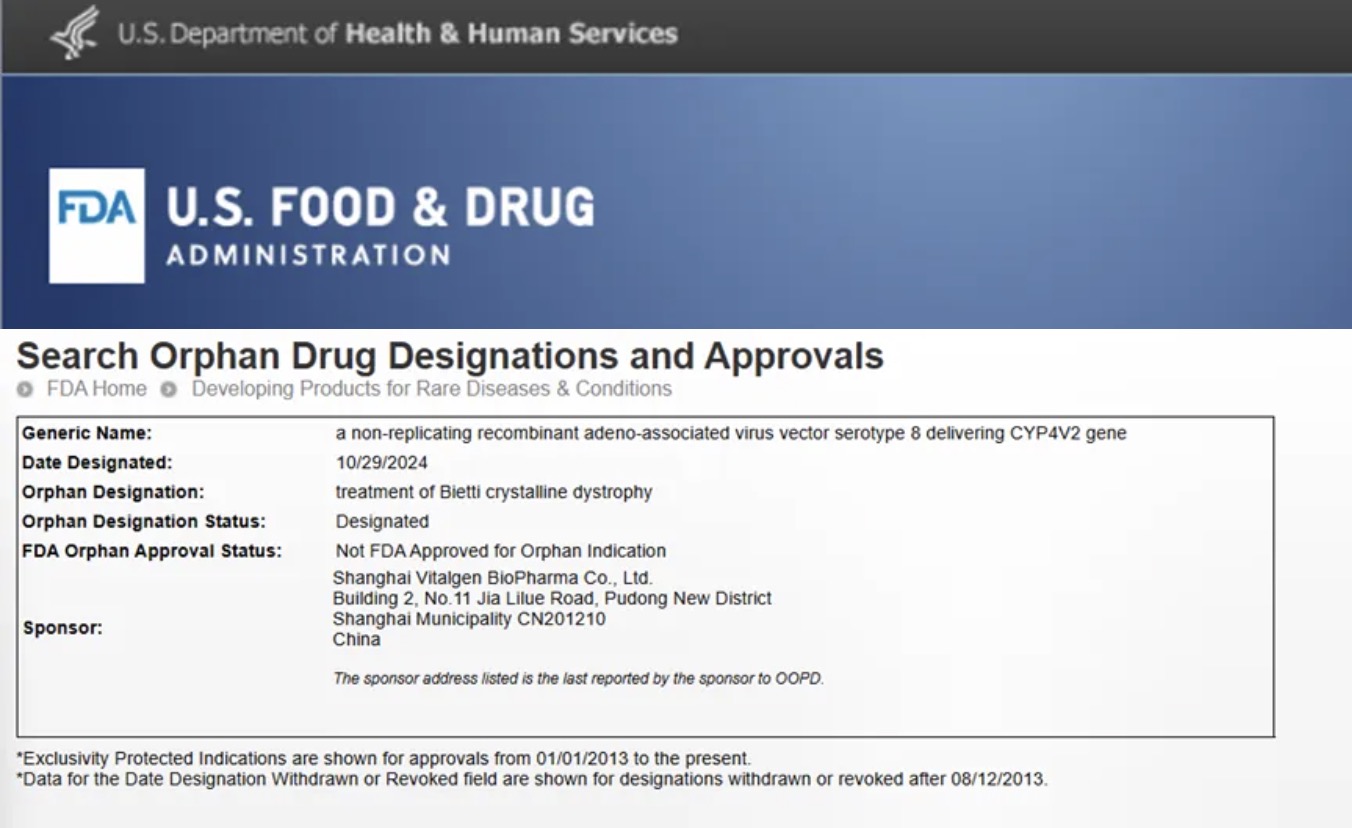
10月29日(美国东部时间),上海天泽云泰生物医药有限公司(以下简称“天泽云泰”)宣布,其自主研发的用于治疗结晶样视网膜变性(BCD)的基因治疗药物VGR-R01获得美国食品药品监督管理局(以下简称“FDA”)授予孤儿药资格认定(Orphan Drug Designation,ODD)。
结晶样视网膜色素变性(Bietti crystalline corneoretinal dystrophy,BCD)是一种常染色体隐性遗传的进展性视网膜变性疾病,1937年由Bietti医生首次描述。BCD的主要临床特征为闪亮的黄白色结晶沉积于视网膜后极部,这种黄白色结晶也可出现在角膜缘浅层及循环的淋巴细胞,同时该病伴有色素沉着的毯层视网膜变性和脉络膜硬化。BCD尚无有效的临床治疗手段,主要参考典型RP,给予如血管扩张剂、维生素及中药治疗等支持性疗法。在国外,目前建议将进展至低视力和法定盲的BCD患者转诊到提供视力损伤康复服务的部门。故亟需一种有效治疗药物研发和上市。
VGR-R01是天泽云泰的在研临床项目进展最快的基因治疗创新药,其通过视网膜下腔注射,AAV衣壳蛋白介导视网膜色素上皮细胞(RPE)的转导,将编码人CYP4V2基因递送至细胞核。表达的CYP4V2蛋白通过纠正患者视网膜内的脂肪酸代谢障碍,以期达到预防或改善RPE细胞、感光细胞及脉络膜的结构和/或功能损伤,并实现纠正视力损伤、保护残存视功能、或延缓视力恶化的临床效果。
天泽云泰此前公布的针对VGR-R01开展的两项临床研究结果表明, 在2~3期BCD患者中,无论是否已存在视网膜脉络膜萎缩,VGR-R01均可预期使患者获益,包括视力提升与功能性视觉改善。
此前,VGR-R01凭借其优异的临床I/II期数据已获得中国国家药品监督管理局药品审评中心突破性疗法认定。此次VGR-R01获得FDA孤儿药资格认定,是本品国际化布局的重要里程碑,有望加快本品推进临床试验及上市注册的进度,同时将有机会在产品研发、注册及商业化等方面享受美国有关孤儿药的政策支持,包括但不限于临床试验费用的税收抵免、免除新药申请费、产品获批上市后将享受7年的市场独占权等。