
VM生物制药是韩国首尔的ViroMed公司的美国分部,它今天宣布美国食品药品监督管理局(FDA)已授予该公司的先导临床试验性药物VM202快速通道资格,该药物是一种处于临床II期的新型基因疗法,是针对肌萎缩性脊髓侧索硬化症(ALS)的一种潜在治疗方法。
ViroMed期待着下半年发表来自临床1/2期试验针对ALS的VM202的治疗数据。试验的主要终点是VM202的安全性和耐受性,而ALS功能性评级(ALSFRS-r)和其他有效性参数的测定则作为试验的次要终点。
“我们很高兴宣布FDA授予快速通道资格给VM202作为对ALS的潜在治疗方式。这情形强调了为ALS患者群体加速开发潜在的新型和重要的治疗选择的需求”,ViroMed有限公司新业务开发主管YuSeungshin博士说道,“快速通道资格加上最近来自FDA的孤儿药资格认定给我们的工作提供了更大的动力,让我们去解决仍存在于ALS患者治疗中的迫切而重大的未满足的医疗需求”。
FDA设立快速通道资格认定程序,可以促进开发和加速评审用于治疗严重的或生命威胁性疾病的药物,而且那样做证明了解决未满足的医疗需求的潜力。
通过快速通道程序,一个药物就可能在提交新药申请时获得优先评审资格,也可具有资格在完整的新药申请提交前将申请材料中已完成的部分提交至滚动审查平台。这些快速推进的流程可以显著削减开发的时间和与带动药物上市相关的成本,并且孤儿药资格的认定还允许该药物即使在相关专利到期后还有7年的市场独占权。
关于肌萎缩性脊髓侧索硬化症

肌萎缩性脊髓侧索硬化症(ALS),也被称作路格里克氏病(Lou Gehrig’sdisease),是一种罕见的未知病因的神经退行性疾病,该病患者身体中动用肌肉所必需的运动神经元被损坏,导致了像舌头、脖子和四肢之类里的所有肌肉的瘫痪。
该疾病主要发生在成年人身上,并且症状产生后的平均预期寿命为2到5年。根据美国国立卫生研究院(NIH)调查,ALS在美国的发病率为每10万人3.9例,而目前全世界估计有45万名患者。根据美国目前大约2万到3万患者的数据,每年估计会有6400名新患者被诊断患有该疾病。
关于VM202
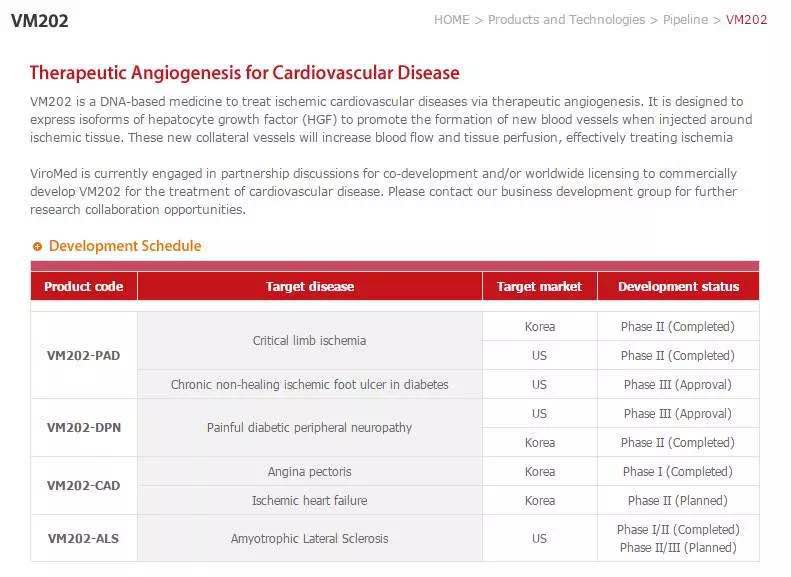
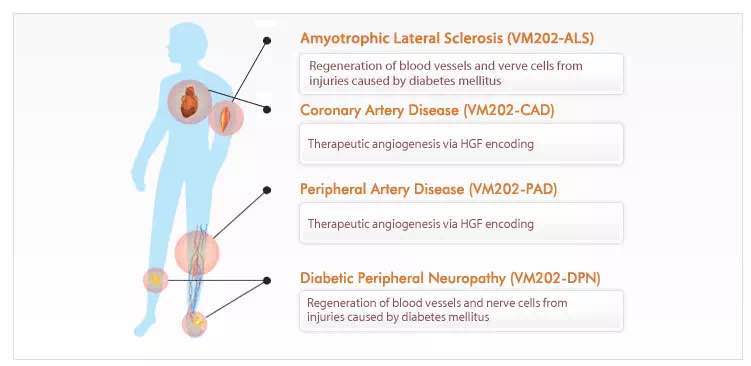
VM202是来自VM生物制药公司的针对四种不同适应症的专有的基因疗法。当被注射进病人体内,VM202会产生肝细胞生长因子(HGF)蛋白,该蛋白会诱导血管新生(形成新生血管)并会作为神经趋向因子刺激被损伤的神经细胞的再生。VM202在美国成功完成了针对肌萎缩性脊髓侧索硬化症(ALS)治疗的临床1/2期研究并于2014年2月6日获得了美国FDA授予的孤儿药地位。
除了针对ALS以外,ViroMed公司正在推进VM202的研究并召募针对痛性糖尿病神经病变(PDN)临床试验的病人-----在其已获得成功的2期临床试验结果后。
公司还完成了VM202治疗严重肢体缺血的一项临床2期研究,并且已取得了FDA对新药临床试验申请(IND)的批准以开始一项针对糖尿病患者的慢性未痊愈缺血性足部溃疡的3期临床试验。还有一项针对冠状动脉疾病(CAD)的VM202的2期临床试验计划在韩国进行。
关于VM生物制药和ViroMed有限公司

VM生物制药是ViroMed有限公司的美国分部,是1996年在韩国首尔创立的着重于研究和开发的生物制药公司。ViroMed公司正在开发用于治疗当前不可治疾病的新的创新型生物药物。目前的开发重点是在治疗心血管和神经性疾病的专有的以质粒DNA为基础的药物VM202,该药在美国、韩国和中国处在不同的临床试验阶段。
ViroMed已形成了一条集技术性与概念性相联接的多样产品线。其他的研究领域包括以抗体为基础的癌症治疗药,免疫疾病,以重组蛋白为基础的血小板减少症治疗方法以及嵌合抗原受体-T细胞治疗(CAR-T)技术。根据临床效果和优质分子生物学研究的持续跟踪记录,ViroMed的目标是成为基因治疗领域的开拓者。
原文链接:
--------------------
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。