BioMarin制药公司今天宣布,欧洲药品管理局(European Medicines Agency,EMA)已通过BioMarin公司关于加速评估Cerliponase α上市许可申请(Marketing Authorization Application,MAA)。加速评估之所以得到批准,是因为该产品可能解决某些未被满足的医疗需求,并且在治疗创新和公共卫生方面有着重要意义。
加速评估可能缩短EMA的审查流程。但是在上市许可申请评估期间的任何时刻,EMA都可能决定回归标准流程,并且大多数开始符合加速评估申请标准的药物最终是按标准流程进行审查的。

Cerliponase α是一种重组人三肽氨基肽酶1(rhTPP1),有意用于治疗患CLN2病的儿童,该病是Batten病的一种类型。CLN2病是一种进展迅速且致命的神经退行性疾病,且没有被认可的治疗方案。
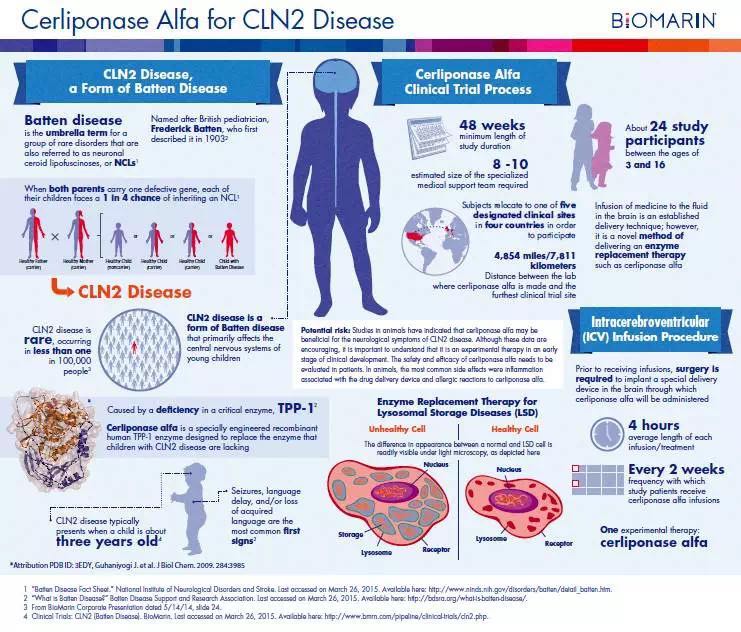
公司期望能在年中前向EMA提交Cerliponase α的上市许可申请和向美国食品药品管理局(Food and Drug Administration,FDA)提交生物制剂许可申请(BiologicsLicense Application,BLA)。如果EMA批准Cerliponase α 的上市许可申请,那么期望在2017年第一季度接受来自人用医药产品委员会(CHMP)的评估,如果通过,在2017上半年就能收到来自欧盟委员会的决定。
“我们很高兴看到EMA已经意识到必须尽快为患有这种特殊类型的Batten病的孩子提供一种治疗方案,而这可能是这些患儿们的首个治疗选择”,BioMarin的主席和首席执行官Jean-Jacques Bienaimé说道,“我们期待着Cerliponase α在全球范围内进入监管审查阶段,CLN2病患者们的医疗需求还远未被满足,我们的期望是为全球患儿提供一种改变生命的治疗选择”。
在美国,BioMarin公司设法通过申请优先审查来缩短监管审查时间。优先审查资格是美国FDA授予在治疗方面有重大进展药物或提供了以前没有有效疗法的治疗药物的特殊资格。FDA会在生物制剂许可申请提交后评定优先审查资格的请求。Cerliponase α已被FDA和EMA认定为孤儿药物,并被FDA认定为具有突破性进展的治疗方法。
提前使用计划
BioMarin制药公司准备在药物获得上市批准之前开展提前使用计划来为更多的CLN2患者提供有限的治疗机会。提前使用计划将按照一项协议进行,计划的规模以及参与人数都有一定的限制。我们期待这个项目将在参与过Cerliponase α研究的研究中心进行。这些中心都有过直接向脑部施药的经验,并确保对这些患者的持续监测。
这个项目预计在2016年第三季度末,至少在一个试点开始施行,而其他试点的施行时间将会因国家和具体试点的不同而不同。这个项目的整体规模,资格标准和其他诸多细节仍在决定之中。BioMarin制药公司必须遵守每个国家的特定法律程序,并已着手准备以确保于2016年第三季度末按时给患者试药。一旦确定,BioMarin制药公司将提供关于这个项目的规模和时间等更多细节。
关于Cerliponase α
Cerliponase α是一种重组人三肽氨基肽酶1(rhTPP1),CLN2病患者体内缺乏这种酶。该药是一种酶替代疗法,旨在恢复TPP1酶活性和分解导致CLN2病的储存物质。为了使药物到达大脑细胞和中枢神经系统,这项疗法采用BioMarin公司的专利技术,将药物直接运送到脑脊液中。
关于疾病CLN2

神经元蜡样脂褐质沉积症(NCLs)是一组不同类型的溶酶体储存障碍疾病,其中包括晚发婴儿型(CLN2)NCLs,一种常染色体隐性遗传的神经退行性疾病。CLN2是由TPP1/CLN2上的基因突变导致三肽氨基肽酶1(TPP1)活性缺乏引起的。在缺乏TPP1时,原本应由该酶分解代谢的溶酶体储存物蓄积在多个器官之中,尤其在大脑和视网膜。
这些储存物在神经系统细胞中的蓄积导致持续进行性的神经退行性变,其表现为认知、运动和视觉功能的丧失。该病进展迅速,症状常于二到四岁之间产生。患者最初表现为语言延迟和癫痫,随后出现活动障碍,运动退化,痴呆,失明甚至夭折。在该病的晚期,进食和完成日常所需变得非常困难,死亡通常发生在十到十六岁之间。
目前没有被认可的治疗可以预防、阻止或治愈CLN2病。对于患有这种罕见病的病人来说,缓解症状、预防和治疗并发症以及尽量维持生活质量是现阶段仅有的可行治疗选择。
关于BioMarin制药公司
BioMarin公司是一家全球生物技术公司,主要为患有严重和威胁生命的罕见病患者开发和商业化创新疗法。该公司的组合由5项上市的产品以及多项临床和临床前阶段的候选产品组成。
原文链接:
--------------------
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。