2025,国家药品监督管理局批准了至少35种罕见病药品,其中包含多款创新药,如赛诺菲治疗血栓性血小板减少症的卡拉西珠单抗、默克治疗腱鞘巨细胞瘤的盐酸匹米替尼胶囊等。
2026 年,国家药监局将倾斜审评资源,助力创新药械 “全球新” 产品提速上市,重点支持罕见病防治等临床急需领域。这些创新疗法凭借 “全球首创” 等核心优势,既填补治疗空白,更给困境中的罕见病患者带来新希望。
罕见病信息网整理了已纳入优先审评、2026 年有望获批的罕见病药品清单,供大家参考。
Wayrilz(rilzabrutinib)01
第一三共创新药盐酸吡昔替尼胶囊于2019年8月2日获美国FDA上市批准,用于治疗存在严重的发病率或功能限制且不适合手术改善的症状性腱鞘巨细胞瘤(TGCT)成人患者,且目前仍是全球首个获批治疗TGCT的药物。在中国,吡昔替尼于2025年1月15日向国家药监局药品审评中心(CDE)提交了上市申请,该药物此前已被正式纳入优先审评程序,这意味着其在国内的上市进程或将大幅提速。
注射用阿帕达酶α02
2025年 4月9日,CDE官网公示,武田(Takeda)申报的注射用阿帕达酶α(Adzynma)上市申请已获得受理。
这款创新的酶替代疗法用于治疗先天性血栓性血小板减少性紫癜(cTTP),已于2023年11月获得美国FDA批准,并成为首款获得FDA批准的cTTP治疗酶替代疗法,适用于成人和儿童患者。
尼卡利单抗03
4月23日,中国国家药监局药品审评中心(CDE)官网最新公示,强生公司(Johnson & Johnson)申报的1类新药尼卡利单抗注射液的上市申请已获得受理。公开资料显示,尼卡利单抗(nipocalimab)是一款靶向新生儿Fc受体(FcRn)的抗体疗法。该产品已于2025年4月获得美国 FDA 批准上市,用于治疗全身型重症肌无力(gMG)患者。

注射用STSP-0601 04
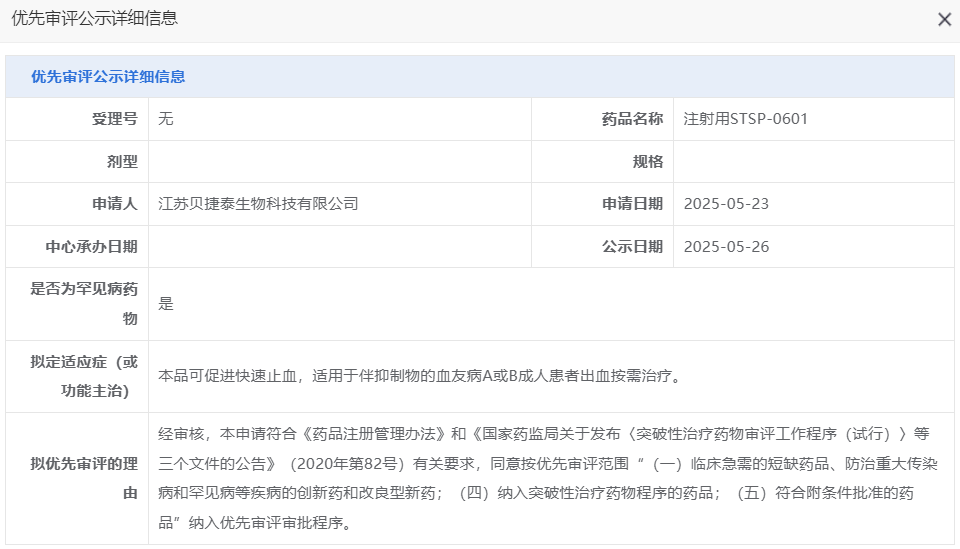
5月26日,CDE官网显示,由江苏贝捷泰生物(舒泰神子公司)申报的注射用STSP-0601拟纳入优先审评,适应症为:本品可促进快速止血,适用于伴抑制物的血友病A或B成人患者出血按需治疗。
利奈昔巴特片05
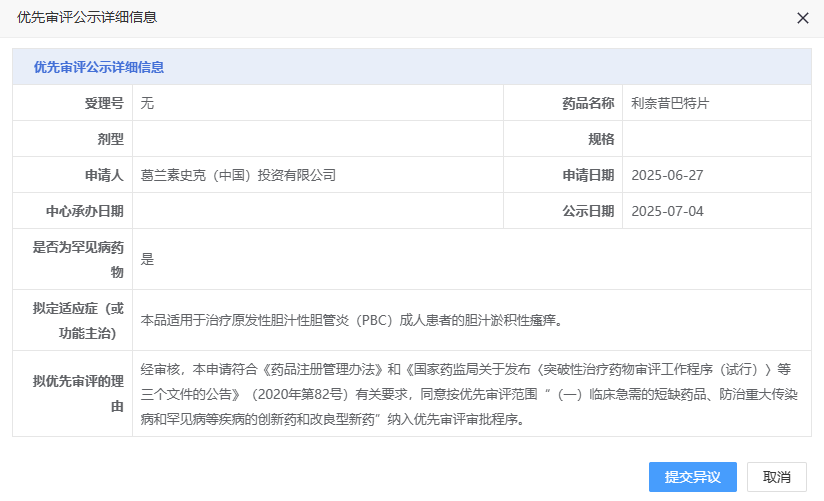
7月4日,CDE官网显示,葛兰素史克(GSK)申报的利奈昔巴特片纳入优先审评,适用于治疗原发性胆汁性胆管炎(PBC)成人患者的胆汁淤积性瘙痒。公开资料显示,这是GSK在研的回肠胆汁酸转运蛋白(IBAT)抑制剂linerixibat。2025年6月2日,Linerixibat新药申请(NDA)已获美国FDA受理,用于治疗原发性胆汁性胆管炎(PBC)患者的胆汁淤积性瘙痒症。
注射用伏索利肽(vosoritide)06
2025年8月22日,根据中国国家药品审评中心(CDE)官网最新公示,精鼎医药研究开发(上海)有限公司申报的注射用伏索利肽拟纳入优先审评品种。公开资料显示,伏索利肽是一种改良的C型利钠肽 (CNP),本次拟纳入优先审评的适应症为用于骨骺尚未闭合儿童患者的软骨发育不全的治疗。
伏索利肽(Vosoritide)原研药是由BioMarin制药公司开发的创新药物,主要用于治疗5岁及以上伴有开放性骨骺(生长板)的软骨发育不全儿童患者。2021年8月在欧盟率先上市,同年11月通过美国食品药品监督管理局(FDA)加速审批并上市,2022年6月21日在日本获批上市。
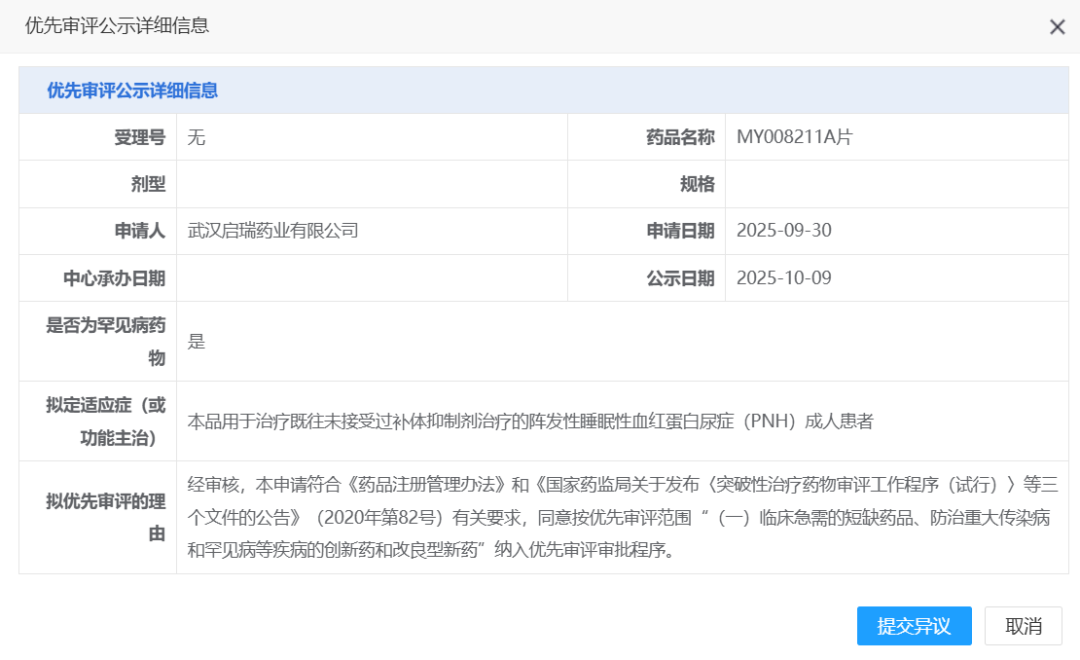
MY008211A片07
2025年10月15日,武汉朗来科技发展有限公司(以下简称“朗来科技”)自主研发的化学药品1类创新药MY008211A片,结束拟优先审评品种公示期,被国家药品监督管理局药品审评中心(CDE)正式纳入优先审评品种名单,用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者。同时,此品种的新药上市许可申请(NDA)已于2025年10月17日被CDE成功受理,进入注册审评阶段。MY008211A是朗来科技自主开发的补体B因子(CFB)抑制剂,其为公司首个进入上市许可申请(NDA)审评阶段的创新药,也是首个国产自研的CFB抑制剂创新药。
Itvisma08
2025年11月24日,诺华(Novartis)宣布,美国FDA已批准Itvisma(onasemnogene abeparvovec)用于治疗年满两岁及以上、已确诊携带运动神经元存活基因1(SMN1)基因突变的脊髓性肌萎缩症(SMA)儿童、青少年及成人患者。
2025年7月14日,该药物已被纳入优先审评,用于治疗6月龄及以上5q型脊髓性肌萎缩症(SMA)患者。2025年8月2日,CDE官网信息显示,Zolgensma上市申请已获受理(受理号:JXSS2500106)。

Tinlarebant09
12月1日,Belite Bio公司宣布其核心药物Tinlarebant在治疗1型Stargardt病(STGD1)的关键3期DRAGON试验中达到主要终点。Tinlarebant是一种新型口服疗法,旨在减少导致STGD1和加剧地理萎缩(GA)进展的维生素A衍生毒素(称为双视黄醇)的积累。它通过减少和维持血清视黄醇结合蛋白4(RBP4)的水平发挥作用,RBP4是将视黄醇从肝脏输送到眼睛的唯一载体蛋白。
目前,NMPA已将Tinlarebant纳入优先审评名单,用于治疗青少年遗传性黄斑变性疾病。

海思科HSK39297片10
2025年12月19日,海思科医药自主研发的1类创新药HSK39297片,其拟定适应症—“适用于治疗既往未接受过补体抑制剂治疗的阵发性睡眠性血红蛋白尿症(PNH)成人患者”,经国家药品监督管理局药品审评中心公示纳入优先审评审批程序。
HSK39297是一种高效、高选择性的口服补体B因子抑制剂。其通过特异性抑制补体旁路途径,同时不影响凝集素途径和经典途径,从而精准阻断末端补体膜攻击复合物介导的血管内溶血和C3b介导的血管外溶血,实现对PNH双重溶血的有效控制。除以PNH为首发适应症的补体介导的溶血性疾病外,该药在补体介导的肾小球疾病、重症肌无力、年龄相关性黄斑变性等多个领域也已获得临床试验许可。

