本周,国家药品监督管理局(NMPA)连续拒绝了118个药品的上市申请。
12月17日,北京远方通达医药技术有限公司研发的醋酸锌片收到国家药监局的拒批通知,宣告本次上市申请失败。该品种于今年9月24日才提交上市申请并获受理,短短三个多月后即遭驳回,创下今年以来仿制药审评最快驳回纪录。
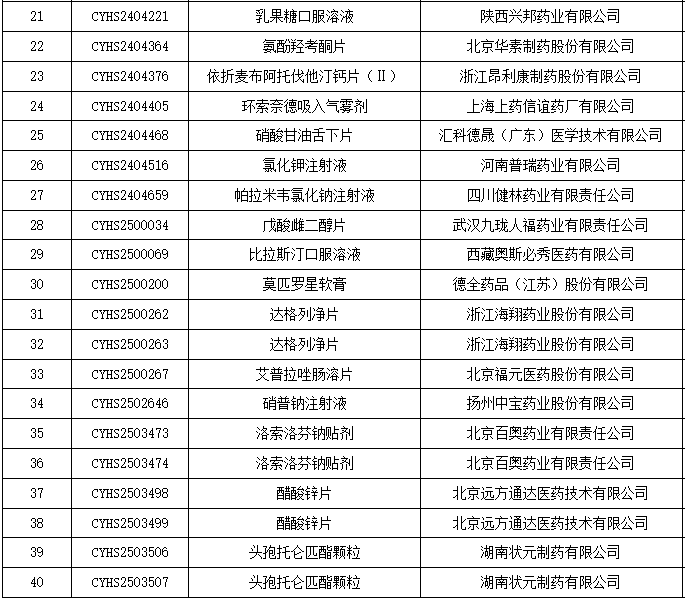
据业内消息,此次申请大概率属于企业“主动撤回”(委托CRO企业——华益药业)。从行业惯例来看,仿制药申请若出现快速驳回或主动撤回,往往与以下因素密切相关:研发过程中的质量控制不达标、生物等效性研究数据存疑、工艺稳定性不足等。
本轮密集驳回的背后,释放出当前药品审评审批持续趋严的强烈信号。这可能与政策相关,2025年12月3日,国家药品监督管理局药品审评中心(CDE)发布《化学仿制药生物等效性研究重大缺陷(试行)(征求意见稿)》,首次系统性划定仿制药研发与申报中的“重大缺陷”清单。
根据该文件,一旦申报项目触及清单所列红线——如关键研究设计缺陷、数据真实性问题、样本量严重不足、主要终点未达标等——将直接不予批准,不再给予“发补”(补充资料)机会。这意味着,企业再难通过后期补正来“挽救”存在根本性问题的申报项目。
肝豆状核变性是一种罕见的常染色体隐性遗传病,患者因基因突变导致铜代谢障碍,过量铜在肝脏、神经系统等器官沉积,若不及时治疗,可引发严重肝损伤、神经功能障碍甚至死亡。目前主要治疗策略是促进铜排泄或减少吸收,常用药物包括青霉胺、曲恩汀等螯合剂以及锌制剂。
研究表明,锌制剂不仅能有效阻断肠道对铜的吸收,还能促进体内沉积铜的清除,且相较于螯合剂,其不良反应更轻微、耐受性更好,特别适合长期维持治疗,在临床中具有重要价值。
2024年2月19日,江苏诺贝仁医药有限公司申报的5.1类新药醋酸锌片已获NMPA批准上市,成为国内首个获批的该品种药物。
在国际市场上,2025年3月3日,美国Eton Pharmaceuticals公司也宣布其Galzin®(醋酸锌胶囊)获FDA批准,进一步验证了该药物的临床价值与市场潜力。
从当前国内研发格局看,除江苏诺贝仁、远方通达外,尚无其他企业提交醋酸锌片的上市申请,仅有武汉科福新药有限责任公司正在进行人体生物等效性研究。
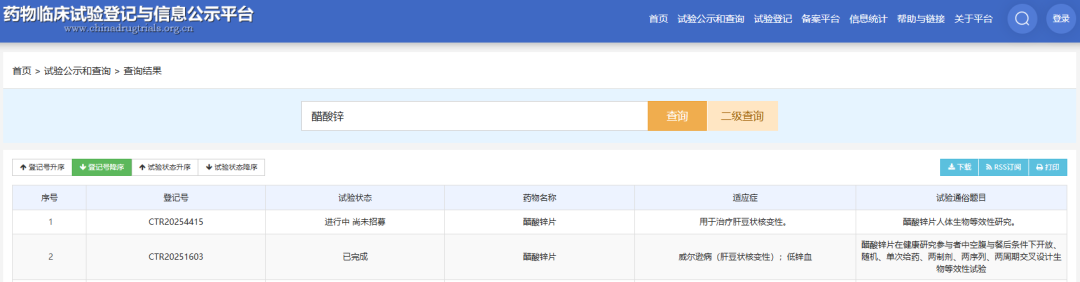
作为罕见病治疗药物,醋酸锌片的市场竞争格局相对清晰,但由于罕见病患者群体规模较小,也对药企的市场推广和成本控制提出了挑战。不过,随着国家对罕见病诊疗和药物保障的重视程度不断提升,相关罕见病药物的研发和上市将获得更多政策支持。