今天,全球罕见病治疗领域传来重磅消息:生物科技公司Capricor Therapeutics Inc. 宣布其在研细胞疗法Deramiocel治疗杜氏肌营养不良症(DMD)关键3期临床研究(HOPE-3)获得积极结果。
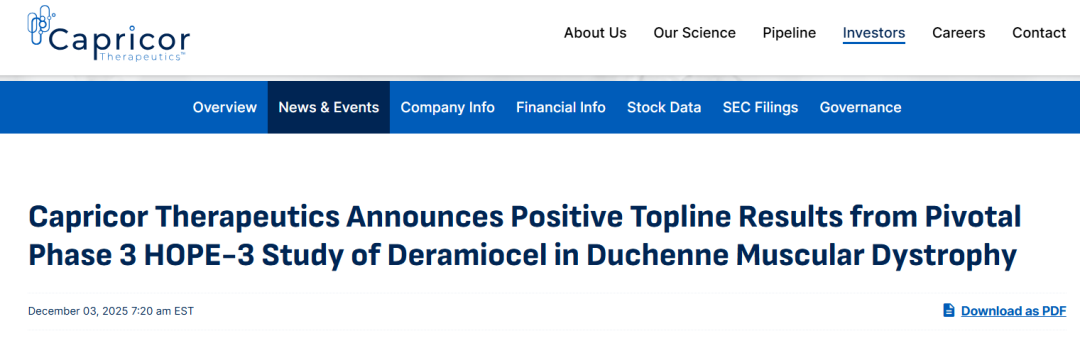
这一突破性进展迅速传导至资本市场,Capricor股价暴涨,截至收盘涨幅仍高达371.07%,总市值跃升至13.7亿美元,因波动幅度触及监管阈值触发临时停牌。而此前该公司曾因FDA拒绝Deramiocel上市申请,股价一度暴跌32%,此次股价的剧烈反弹直观反映了市场对该疗法临床价值的认可。
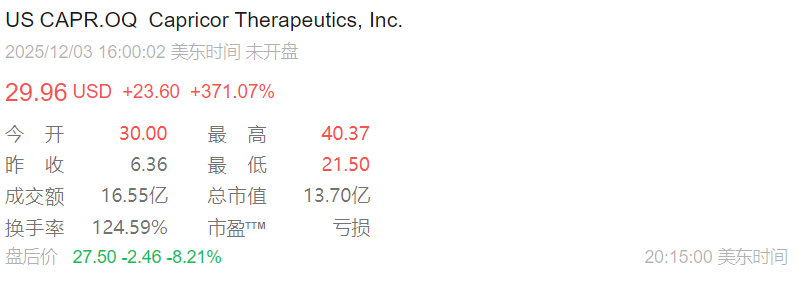
HOPE-3 是一项随机、双盲、安慰剂对照的三期临床试验,评估 Deramiocel 治疗DMD的安全性和有效性。该研究随机分配了106名参与者,分布在美国20个主要临床地点。参与者每次输注1.5亿细胞静脉注射Deramiocel,或每三个月服用安慰剂,持续12个月。参与者的平均年龄约为15岁,且所有参与者在整个研究期间均采用稳定的皮质类固醇方案。基线人群在治疗组间平衡良好,约90%的患者在基线接受心脏用药,超过75%的患者临床诊断为心肌病。Deramiocel的安全性和耐受性与以往临床经验一致。
上肢功能评估中,接受deramiocel治疗(每三个月注射一次,持续一年)的患者,功能衰退速度比安慰剂组减缓了54%;心脏功能保护方面,在83名受试者的左心室射血分数(评估心脏泵血能力的关键指标)监测中,deramiocel使心脏功能恶化速度减缓了91%。
作为一种致命性X连锁隐性遗传病,DMD主要侵袭男性群体,其致病根源在于抗肌萎缩蛋白基因突变导致的肌肉组织进行性退化。据临床数据显示,全球每3500名新生男婴中约有1例患病,患者通常在5-6岁出现行走困难,12岁左右丧失独立行走能力,20-30岁便会因心脏或呼吸衰竭离世。即便在规范治疗下,患者生存期虽能延长,但长期依赖的激素治疗存在生长发育落后、骨质疏松等副作用,且全球范围内始终缺乏能有效延缓疾病进展、改善心脏功能的根治性疗法,临床需求极为迫切。在中国,这一问题同样严峻,预估约有7万名DMD患者,超过70%的患者家庭年均医疗支出占家庭总收入的60%以上。
HOPE-3 PUL研究的阳性结果,成为验证该疗法价值的关键证据。“研究结果表明,Deramiocel在上肢功能和心肌病方面具有显著且重要的治疗效果,兼具统计学意义和临床意义。”该试验全国首席研究员、加州大学戴维斯分校健康中心杰出教授Craig McDonald博士指出,治疗后患者骨骼肌疾病进展速度减缓近54%,这一数据在DMD治疗领域极为罕见,直接关系到病情严重患者的独立性维持和生活质量提升。更值得称道的是,该研究是首个在大幅丧失行走能力的DMD患者群体中成功达到主要终点的三期试验,其证实的上肢功能保留效果为患者带来实际获益,而对心肌病的改善作用更有望提升患者长期生存率。
范德堡大学医学中心儿科(心脏病学)教授、医学博士、MSCI博士Jonathan Soslow表示:“HOPE-3的心脏病发现代表了杜氏肌营养不良症治疗的重大进展。”“心肌病是杜氏地区死亡的主要原因,稳定心脏功能一直是重大未被满足的需求。在HOPE-3中观察到的Deramiocel治疗患者左心室射血分数的统计和临床显著保留,凸显了Deramiocel解决该疾病最关键方面之一的潜力。”
这一突破不仅可能重塑Capricor公司自身估值,更将对全球罕见病治疗领域产生深远影响。长期以来,DMD治疗研发资源多集中于基因编辑(如CRISPR技术)、外显子跳跃等方向,细胞疗法因技术复杂度高、研发及应用成本高昂,始终处于“小众赛道”地位。而HOPE-3试验的成功,首次以三期临床数据证实了细胞疗法在DMD治疗中的核心价值,业内普遍认为,这将打破行业认知壁垒,带动资本重新审视并布局该领域。
目前,Deramiocel已获得全球监管机构的多重资质背书,为其后续商业化进程奠定坚实基础。该产品已同时斩获美国FDA和欧洲药品管理局(EMA)授予的DMD孤儿药资格,在美国还获得再生医学先进疗法(RMAT)认定,在欧洲取得先进治疗药物(ATMP)认定,此外更拿下FDA罕见儿科疾病认定。根据监管规则,若后续成功获批,Capricor公司有望获得优先审评券,进一步加速产品上市进程。
随着细胞疗法在DMD领域实现关键突破,加之全球范围内超过40个DMD临床在研项目推进,业内专家预测,未来十年DMD患者平均寿命有望得到显著提升。而Deramiocel的研发进展,不仅为DMD患者家庭带来希望,更将为整个细胞疗法在罕见病治疗领域的应用开辟新的想象空间。