12月1日,Belite公司宣布了其关键性的全球III期“DRAGON”试验的顶线结果,该试验针对青少年Stargardt病1型(STGD1)患者的口服候选药物Tinlarebant。

新闻稿指出,这是首个针对1型Stargardt病(STGD1)患者的关键性试验取得成功。STGD1是一种眼部疾病,会导致进行性视力丧失,通常始于儿童期或青年期,目前全球尚无获批的治疗方法。
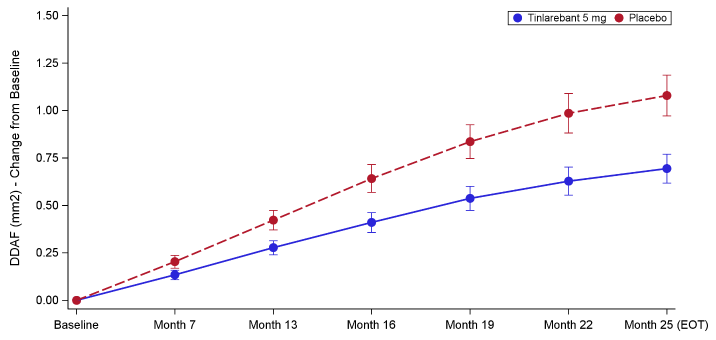
DRAGON III期临床试验纳入了104例STGD1患者,并达到了其主要疗效终点,结果显示,与安慰剂组相比,治疗组视网膜病变的生长速度显著降低36%,该降低通过眼底自发荧光成像测量,表现为自发荧光强度明显降低(DDAF)。采用预设分析方法后,结果具有统计学意义(p值=0.0033)。考虑到STGD1的进展性特征,进一步的事后分析提供了特定的数据相关性,结果显示治疗效果仍然显著(p值<0.0001)。
Tinlarebant是一种新型口服疗法,旨在减少导致STGD1和加剧地理萎缩(GA)进展的维生素A衍生毒素(称为双视黄醇)的积累。它通过减少和维持血清视黄醇结合蛋白4(RBP4)的水平发挥作用,RBP4是将视黄醇从肝脏输送到眼睛的唯一载体蛋白。
通过调节进入眼睛的视黄醇量,Tinlarebant减少了双视黄醇的形成。在DRAGON试验中,Tinlarebant(每日口服5毫克)实现了RBP4水平相对于基线平均约80%的降低。除了在研究眼中将病灶生长率降低了35.7%(p=0.0033)之外,对侧眼的主要终点也观察到了具有统计学意义的治疗效果,病灶生长减少了33.6%(p=0.041)。此外,关键次要终点——减少自发荧光(DAF)病灶生长,在研究眼中减少了33.7%(p=0.027),在对侧眼中减少了32.7%(p=0.017)。
在为期两年的研究中,Tinlarebant的耐受性良好,其安全性特征与先前观察到的数据和作用机制保持一致。只有四例与治疗相关的药物中断或退出。最常见的药物相关眼部不良事件是黄视症(Xanthopsia)和暗适应延迟。大多数黄视症、暗适应延迟和夜视障碍都是轻微的,并且在试验期间得到缓解。24个月的研究期间视力结果符合预期,两组的视力总体变化很小。Belite指出所观察到的病灶生长减少最终会转化为可测量的视功能益处。
Belite计划在2026年上半年向美国FDA提交新药申请(NDA),这一积极进展使得Belite有望成为首家在美国推出STGD1治疗药物的公司。
Tinlarebant已获得多项重要的监管认定,包括美国快速通道和罕见儿科疾病认定,以及美国、欧洲和日本的孤儿药认定。
数据公布后,Belite Bio公司股价大涨12%,总市值约54亿美元,反映了市场对其成为美国首家推出STGD1疗法公司的期待。
在国内,有3家医院参加了DRAGON研究。目前,NMPA已将Tinlarebant纳入优先审评名单,用于治疗青少年遗传性黄斑变性疾病(Stargardt 病)。
