2025 年 8 月 26 日,再生元制药公司宣布,在评估成人全身性重症肌无力(gMG)的研究性森迪西兰(Cemdisiran )单药治疗的 3 期 NIMBLE (一项随机、双盲、安慰剂对照临床试验(n=190))试验中,达到了主要和关键次要终点。再生元公司计划于 2026 年第一季度将cemdisiran 单药疗法提交监管申请,等待与 FDA 讨论。
cemdisiran 是一种降低补体因子 5 (C5) 循环水平的小干扰RNA(siRNA)药物。cemdisiran单药治疗可抑制约74%的补体活性。

关于NIMBLE 试验
NIMBLE 试验针对有症状、抗乙酰胆碱受体(抗 AChR)抗体阳性的成年 gMG 患者开展。
患者被随机分配接受皮下注射:每 12 周一次 cemdisiran(600 mg);每 4 周一次 cemdi-poze(cemdisiran 200 mg 和 pozelimab 200 mg);每 4 周一次安慰剂。
主要终点评估了重症肌无力日常生活活动 (MG-ADL) 总分从基线到第 24 周的总分变化,用于测量受 gMG 影响的日常功能,例如说话、进食、呼吸、视力和活动能力。
关键次要终点评估了定量重症肌无力 (QMG) 总分相对于基线的总分变化,这是一项由医生管理的评估,用于评估视力、说话/吞咽、呼吸和肢体功能。
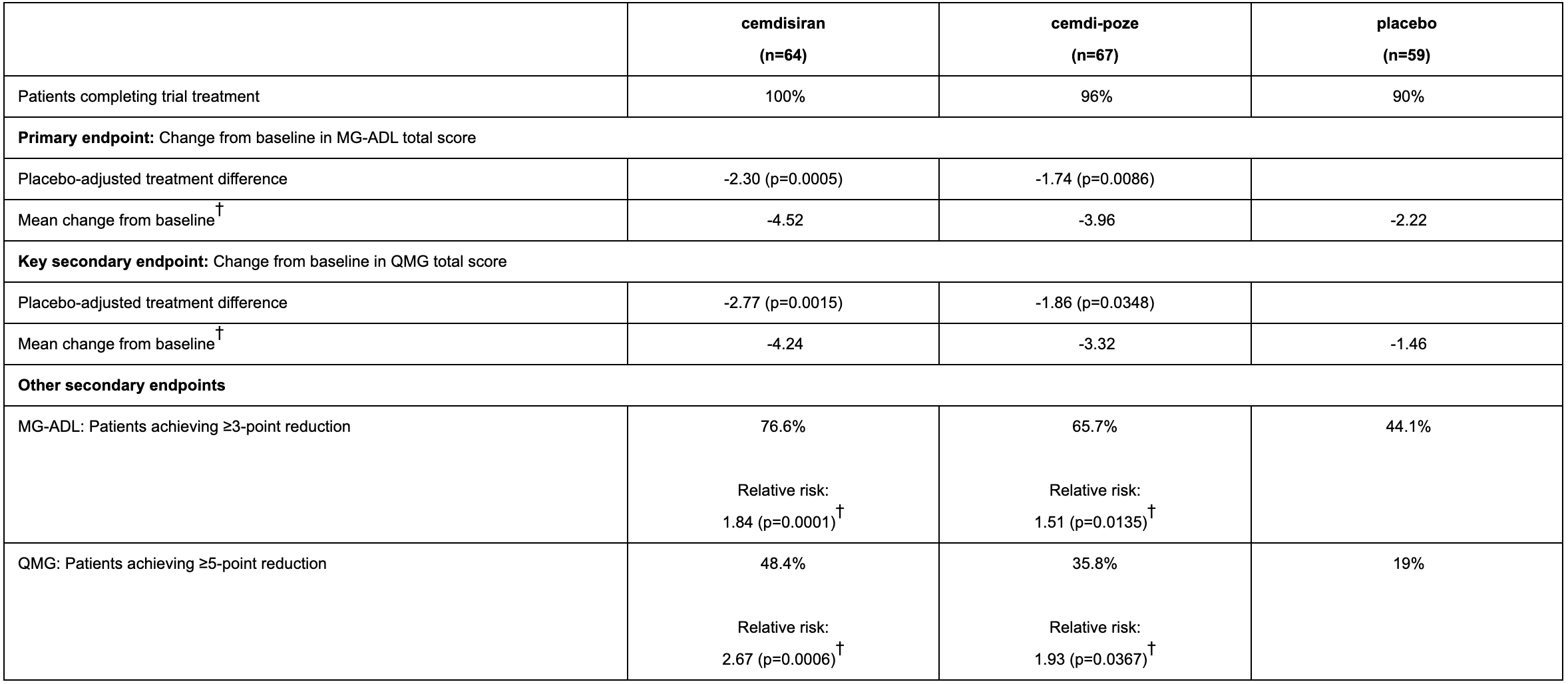
试验结果
在第 24 周时,cemdisiran 和 cemdi-poze 的日常功能活动均有所改善,其中,cemdisiran 结果更好(在MG-ADL和QMG中,总分降低幅度越大,说明疾病症状改善越大,治疗效果越好)。
cemdisiran 单药治疗MG-ADL 总分相比安慰剂治疗差异为 -2.3 分(cemdi-poze治疗组为-1.74分)。对比其他药物,目前批准的 C5 抑制剂疗法在 12 至 26 周 MG-ADL 总分相比安慰剂治疗差异范围仅为 -1.6 至 -2.1。
不良反应
在所有组中,69% 接受 cemdisiran 治疗的患者发生治疗中出现的不良事件 (TEAE), 而 cemdi-poze 治疗组和安慰剂组分别是81%、77% 。3% 接受 cemdisiran 治疗的患者出现严重 TEAE,而cemdi-poze 治疗组和安慰剂组分别为9% 、14% 。
在接受 cemdisiran、cemdi-poze 或安慰剂治疗的患者中,≥5% 中观察到的最常见 TEAE 是:MG 恶化 (1%、5%、17%)、上呼吸道感染 (12%、8%、11%)、尿路感染 (5%、6%、3%)、鼻咽炎 (5%、3%、4%)、头痛 (5%、11%、10%)、皮疹 (5%、3%、1%)、注射部位反应 (4%、8%、1%)、腹泻 (3%、14%、7%)、 关节痛 (1%、6%、1%)、四肢疼痛 (1%、5%、1%)、咳嗽 (1%、5%、1%) 和瘙痒 (0%、5%、0%)。
关于重症肌无力 (MG)
MG 是一种罕见的慢性自身免疫性疾病,异常抗体会激活包括 C5 在内的补体系统,破坏神经和肌肉之间的通讯,导致衰弱并可能危及生命的肌肉无力。约85%的MG患者会经历疾病症状的进一步发展,被称为gMG。
再生元董事会联席主席、总裁兼首席科学官George D. Yancopoulos医学博士认为,cemdisiran单药治疗有不完全补体阻断的最佳疗效潜力,可能提供更有利的安全性。这些结果凸显了再生元公司siRNA 和基因药物管线在为患者提供改变范式的疗法方面的变革潜力。
参考资料:https://investor.regeneron.com/news