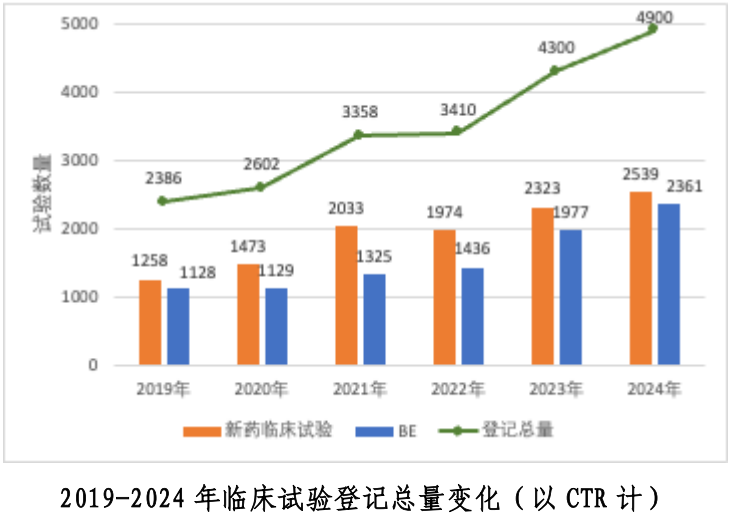
日前,国家药监局药品审评中心(以下简称“药审中心”)发布了《中国新药注册临床试验进展年度报告(2024年)》。报告显示,2024年药物临床试验登记总量达到4900项,较2023年增长了13.9%。其中,新药临床试验数量为2539项,增长了9.3%。这一增长趋势表明,我国新药研发活动持续活跃,创新药物研发不断加速。
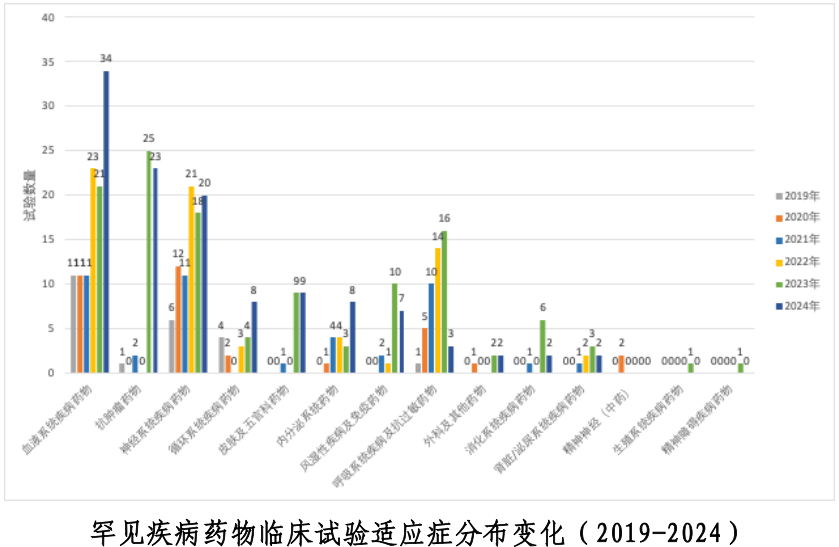
去年,中国罕见病药物临床试验登记量达121项,较往年持续增长,凸显罕见病领域研发活跃度提升。从近五年的历史趋势看,罕见病试验数量呈逐年递增态势,反映政策引导与行业关注度的提高。
以罕见疾病中文名称为关键字对罕见疾病药物临床试验进行分析。从临床试验数量上看,呈逐年递增趋势,2024年共登记 121 项。按药物类型分析,治疗罕见疾病的药物主要为化学药品和生物制品,分别登记了 39 项和 82 项。按适应症分析,主要以血液系统疾病、神经系统疾病和抗肿瘤药物为主,共计 77 项,占年度罕见疾病药物临床试验总量的63.6%,其中血液系统疾病药物临床试验数量最多,共 34 项,占年度罕见疾病临床试验总量的 28.1%。
生物制品(82项)主导罕见病研发,与基因治疗、单抗等先进技术应用密切相关。
报告显示,2024 年细胞和基因治疗类药物新增首次登记临床试验115 项(以 CTR 计),较 2023 年增加了 42.0%(115 vs. 81)。上述 115 项试验共涉及 100 个品种(以药品名称计),其中细胞治疗类 62 个品种,基因治疗类 38 个品种,适应症以抗肿瘤为主(50 项,43.5%)。
报告显示,临床试验获批和BE备案后完成首次临床试验登记的平均用时进一步缩短,1个月以内完成试验登记并提交的占比均较2023年提高。新药临床试验批准后的试验启动平均用时进一步缩短,6个月内签署首例知情同意书的比例提高至65.5%。这些效率的提升,有助于加速新药研发进程,缩短患者等待时间。
临床试验组长单位和参加单位主要分布在北京市、上海市、江苏省、湖南省和广东省。儿童临床试验组长单位主要集中在北京市,广东省临床试验机构参与儿童临床试验的次数最多。这些地区凭借其丰富的医疗资源与科研实力,成为新药临床试验的聚集地。
综合来看,2024年中国新药注册临床试验展现出以下显著特点:临床试验登记总量持续增长,反映出新药研发的积极态势;1类创新药占比突出,II、III期临床试验占比稳步增加;抗肿瘤创新药III期临床试验保持增长势头;儿童临床试验数量及占比持续上升等等。
这些特点不仅表明中国新药研发的活跃度不断提升,创新药研发稳步推进,也反映出临床试验效率的显著优化。