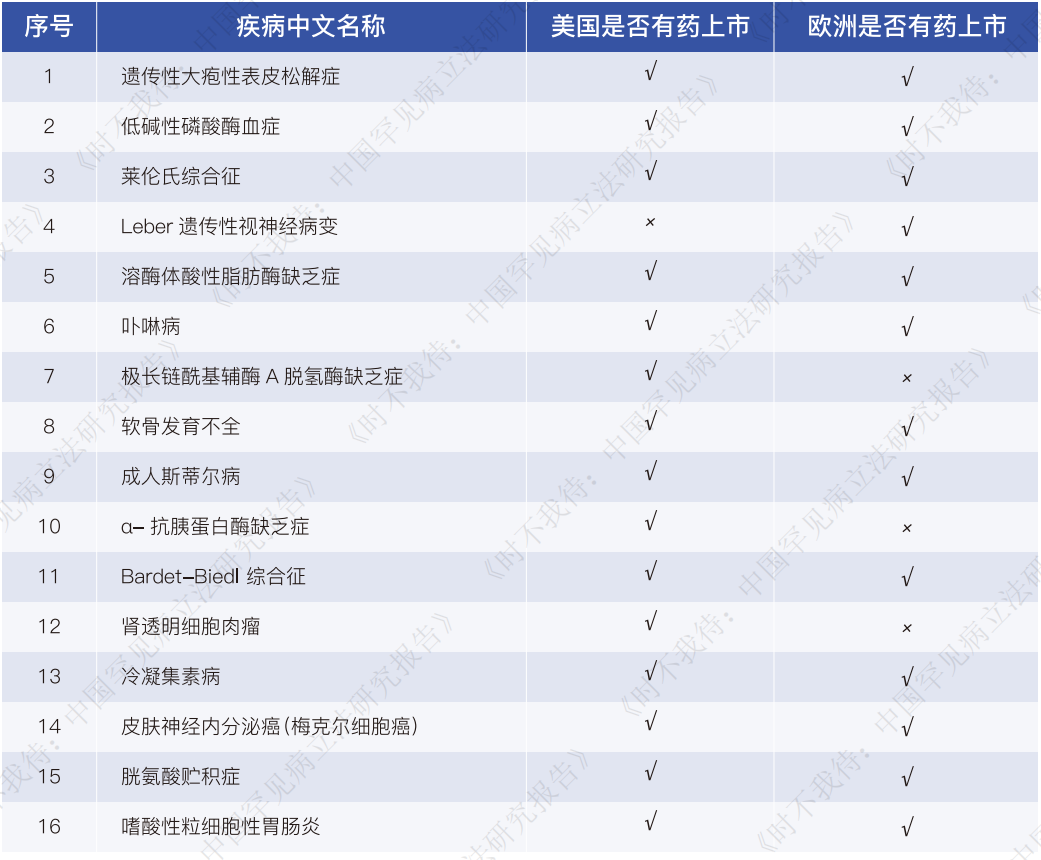
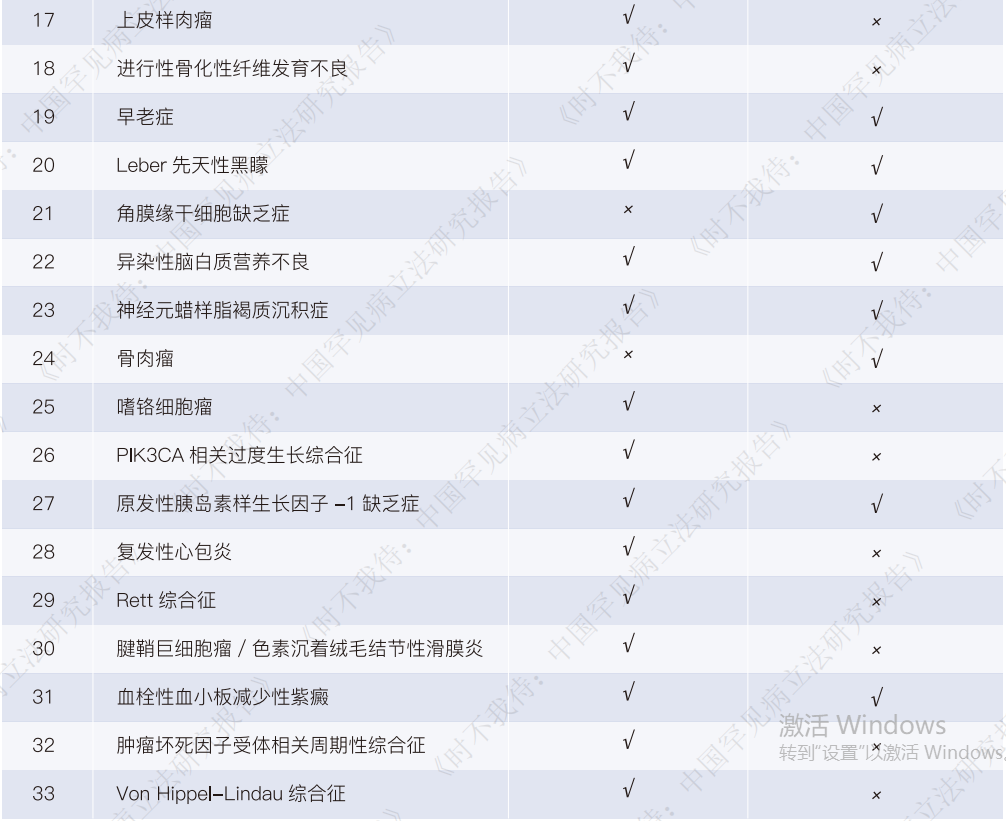
全球已上市的800多种罕见病药物,仅有10%左右在我国获批上市。按照国家卫健委等部门发布的《第一批罕见病目录》和《第二批罕见病目录》为界定依据,目录内70%的罕见病在我国没有任何上市的有效疗法,其中有33种罕见病,患者仍面临“境外有药、境内无药”的困境。针对全球无药的罕见病,我国在研发新药上,也缺乏系统性的政策支持,国内有意愿做罕见病新药研发的屈指可数。
等待救命药的卟啉病患者
卟啉病(Porphyria)的患病率约为1/50,000,在国内约有6,000名患者,目前罕见病发展中心和卟啉关爱中心注册登记的患者约有60名。人血红素(Human hemin)是卟啉病唯一的治疗性用药,早在20多年前就已在欧美被广泛使用,但在我国仍未能上市。卟啉病患者平均每年发病7~8次,平均每次发病需要使用4支人血红素,年治疗花费约为20万元人民币。
类似“我不是药神”的故事正在卟啉病患者中上演。为了活下去,国内卟啉病患者只能冒着一系列风险通过海外渠道代购人血红素治病。首先,人血红素的说明书里明确要求需在2~8℃的条件下储藏药品,而在国际转运过程中难以控制药品高温失效的风险。其次,人血红素是静脉注射剂,国内医疗机构不予注射外购药品,许多患者只能前往不正规的小诊所输注甚至是自行输注,而对副反应的处理一旦失控将是致命的。最后,即便能够获得医院和医生的处方支持,海外代购血液制品仍是踩在法律法规边缘的危险行为。
如果不冒险进行海外代购呢?在缺乏药物治疗的情况下,卟啉在体内的累积会导致卟啉病患者出现四肢神经乃至大脑神经麻痹,最终死亡。据卟啉关爱中心的统计,在过去的2018年里,已有4名卟啉病友离开了人世。
不是每一个患者最终都能等到药物在中国上市的那一天。
从市场需求来看,我国罕见病患者仍存在巨大的未满足需求,目前我国在罕见病领域最突出的矛盾之一,仍是药品的可及性问题:
首先,全球已获批上市罕见病药物有超过800种,然而只有不到20%的药物在我国获批上市。按照国家卫健委等部门发布的《第一批罕见病目录》和《第二批罕见病目录》为界定依据,目录内70%的罕见病在我国都缺乏已批准上市的有效疗法,其中有33种罕见病,患者面临“境外有药、境内无药”的困境。针对全球无药的罕见病,我国在研发新药上,也缺乏系统性的政策支持,国内有意愿做罕见病新药研发的屈指可数。绝大多数的罕见病救命药仍未能进入中国市场。
其次,虽有三分之二的罕见病药品已被纳入国家医保目录,但绝大多数为“老药”、“老分子”,因其有罕见病适应症而被记入,罕见病特效药被纳入医保的仍是少数。罕见病高值药物(年治疗费用超过30万元)的保障问题仍面临系统性的障碍。近年来,多个高值罕见病药品,因价格问题直接“放弃申报”国家医保谈判。主动申报通过形式审查的高值药,也多因价格因素无缘谈判。
最后,已上市的罕见病药品中,来自我国本土自主创新的占比极低,在105种国产药品中,绝大多数为仿制药或生物类似药,只有1个改良新药、5个1.1类创新药。稍微延申去看,国产仿制药上市后,也并未能解决我国患者的支付难题,价格普遍是原研药品的60%以上,甚至多个产品价格超过原研的80%。2023年热议的氢化可的松片涨价十倍,正是其中一个缩影。
而在更为广义的产业概念里,罕见病产业还应包含器械、疫苗、特医食品、罕见病互联网诊疗、康复服务、商业保险等等。然而,这些都因为缺乏系统性的政策支持,而尚未得到关注和发展。
本文摘自《时不我待:中国罕见病立法调研报告》,如需纸质版报告请通过下面二维码获取,也欢迎罕见病行业从业者、媒体记者、患者家庭、政府部门能将本报告传阅给更多政策推动者。期待更多读者对报告提出批评建议!
