Aro Biotherapeutics是一家致力于开发强效组织靶向药物的临床阶段生物技术公司,前不久宣布美国食品和药物管理局(FDA)已批准ABX1100的研究性新药申请(IND),ABX1100是一种新型疗法,目前正在对晚发性庞贝病(late-onset Pompe disease,LOPD)患者进行一期研究。
此前来自正常健康志愿者(NHV)的1期研究的数据,显示ABX1100在肌肉中糖原合酶1(GYS1)信使RNA(mRNA)和蛋白质的持久降低。ABX1100也具有良好的耐受性,并在NHV的1期试验中表现出可预测的药代动力学(PK)。
Aro联合创始人、总裁兼首席执行官Susan Dillon博士表示:“FDA批准我们的IND,再加上1期健康志愿者试验的令人鼓舞的数据,为ABX1100临床开发计划提供了巨大的动力。”
LOPD患者在分解肌肉糖原酶方面存在遗传缺陷,糖原是一种用于提供能量储存形式的糖。因此,患者在肌肉组织中储存的糖原水平过高,导致疾病。使用Aro的Centyrin技术,ABX1100旨在将短干扰RNA(siRNA)治疗有效载荷直接递送到肌肉组织,以抑制GYS1的产生,GYS1是合成糖原所需的关键酶。通过减少糖原的产生,Aro希望为患者带来一种新的治疗方法。Aro最近宣布,其ABX1100在加拿大LOPD患者中的开放标签1期临床试验中的首位患者已给药。
在已完成的1期NHV研究中,与基线给药前水平相比,ABX1100在肌肉活检样本中显示出剂量和时间依赖性GYS1 mRNA和蛋白质降低。研究人员观察到,在第1天和第29天给药2次ABX1100后10周,GYS1 mRNA和蛋白质的降低率约为70%,这表明GYS1降低的潜在治疗水平,并支持负荷剂量后每季度维持一次剂量的理论基础。药代动力学分析表明,血浆中可快速清除,但在肌肉中持续存在。
Aro的联合创始人兼首席科学官Karyn O'Neil博士评论道:“1期结果表明,向肌肉递送一致且剂量依赖性的ABX1100能够持续有效地降低GYS1。这为我们的Centyrin siRNA平台提供了第一个从实验室到患者的临床证据。”
ABX1100是一种针对庞贝病的研究性治疗方法,由结合CD71受体的Centyrin与短干扰RNA(siRNA)结合而成,siRNA特异性干扰肌肉组织中GYS1信使RNA(mRNA)的表达,从而降低GYS1的水平和整体活性,GYS1是合成糖原所需的关键酶。ABX1100正处于治疗庞贝病的早期开发阶段,并已获得FDA的孤儿药资格认定和儿科罕见病资格认定。
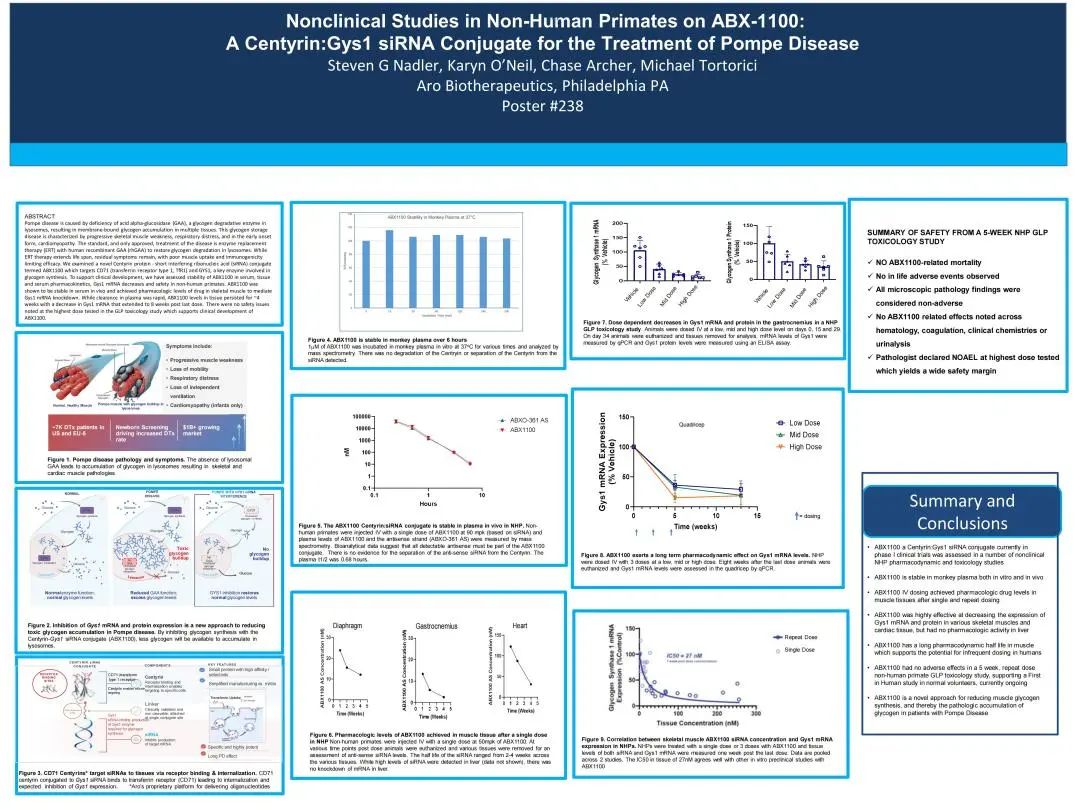
图:该公司官网
ABX1100在所有剂量水平下均具有良好的耐受性,在治疗后85天内没有报告严重不良事件(SAE),也没有因不良事件(AE)而提前停药。大多数不良事件是短暂而轻微的。研究中没有贫血的报告。
|关于庞贝病
庞贝病是一种罕见神经肌肉疾病,由α-葡萄糖苷酶的遗传缺陷引起,导致肌肉中糖原的毒性积聚。这种积聚导致肌肉功能逐渐丧失、虚弱和残疾,最终可能因呼吸衰竭而死亡。晚发性庞贝病(LOPD)是庞贝病的一种亚型,通常在青春期或成年期确诊。目前治疗LOPD的标准是酶替代疗法,旨在恢复分解肌肉糖原酶的遗传缺陷。然而,标准护理的疗效有限,每月多次长时间静脉注射(IV)会带来巨大治疗负担。
原文标题:
Aro Biotherapeutics Announces U.S. FDA Clearance of IND Application for ABX1100 for Potential Treatment of Late-Onset Pompe Disease (LOPD)