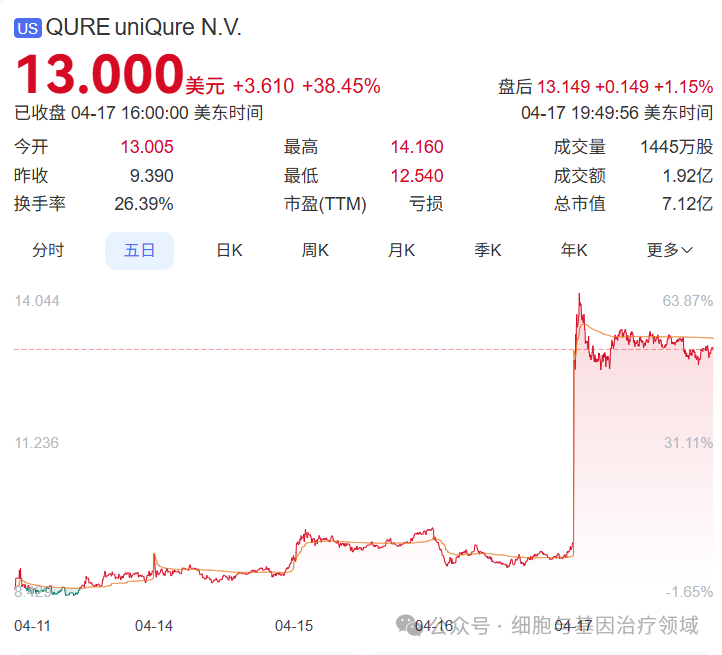
近日,基因治疗企业uniQure宣布,其针对亨廷顿舞蹈症(Huntington’s disease)的在研基因疗法AMT-130获美国食品药品监督管理局(FDA)授予突破性疗法认定(Breakthrough Therapy Designation)。此前,该药物已获得再生医学先进疗法(RMAT)、孤儿药及快速通道等资格认定。此次获批突破性疗法认定这一进展标志着AMT-130在加速审批和临床开发路径上又迈出关键一步。受此消息利好,公司股价单日涨幅达38.45%。
突破性疗法认定的意义
FDA的突破性疗法认定旨在加速治疗严重疾病且初步临床证据显示显著优于现有疗法的药物开发。对于亨廷顿病——一种由基因突变引发的致命性神经退行性疾病,目前尚无改变疾病进程的疗法,AMT-130的突破性认定无疑为患者带来新希望。
uniQure首席医疗官Walid Abi-Saab博士表示:“AMT-130的突破性认定反映了亨廷顿病患者对有效疗法的迫切需求,也印证了早期临床数据中疾病进展减缓的潜力。我们期待与FDA紧密合作,尽快将这一创新疗法推向市场。”
临床数据与研发进展
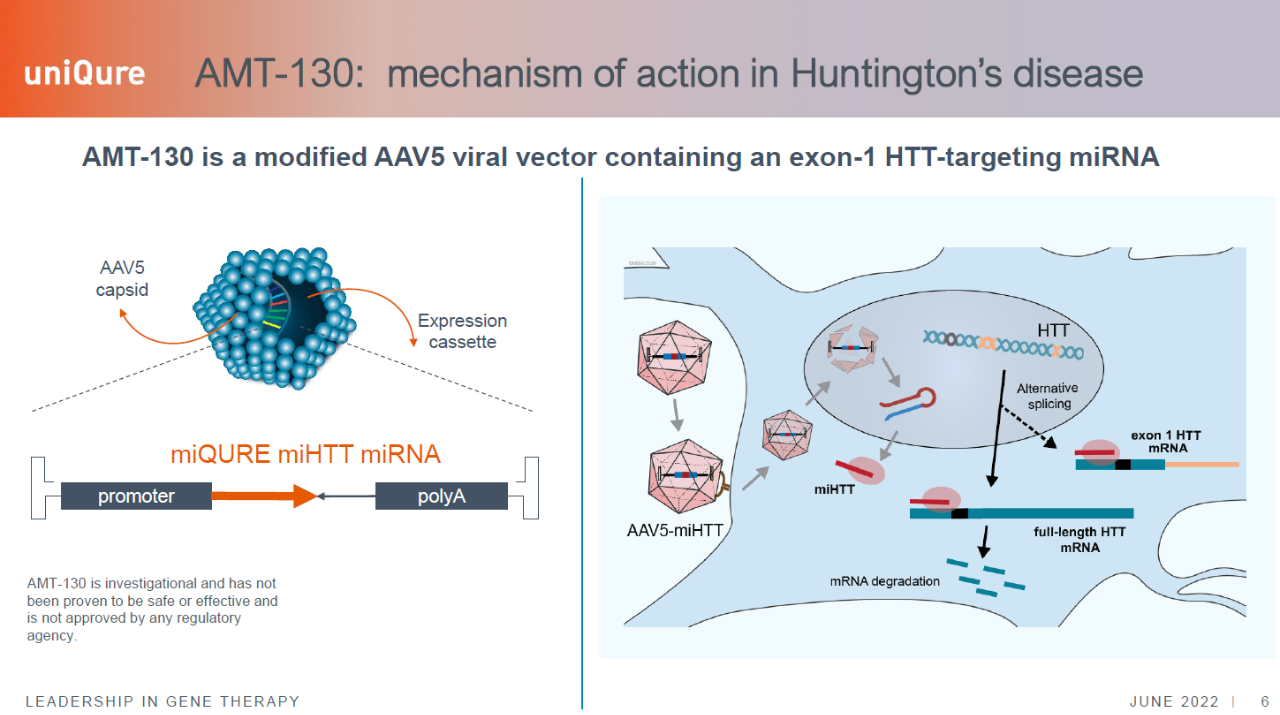
AMT-130是一种基于腺相关病毒5型(AAV5)载体的基因疗法,通过靶向沉默亨廷顿基因(HTT)突变表达,抑制毒性蛋白mHTT的生成。

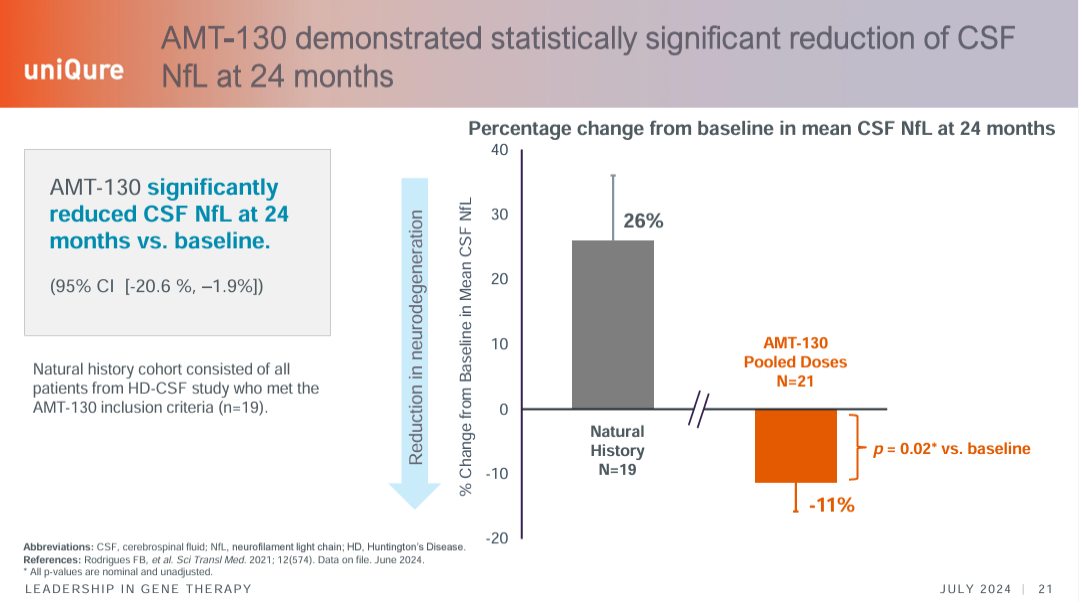
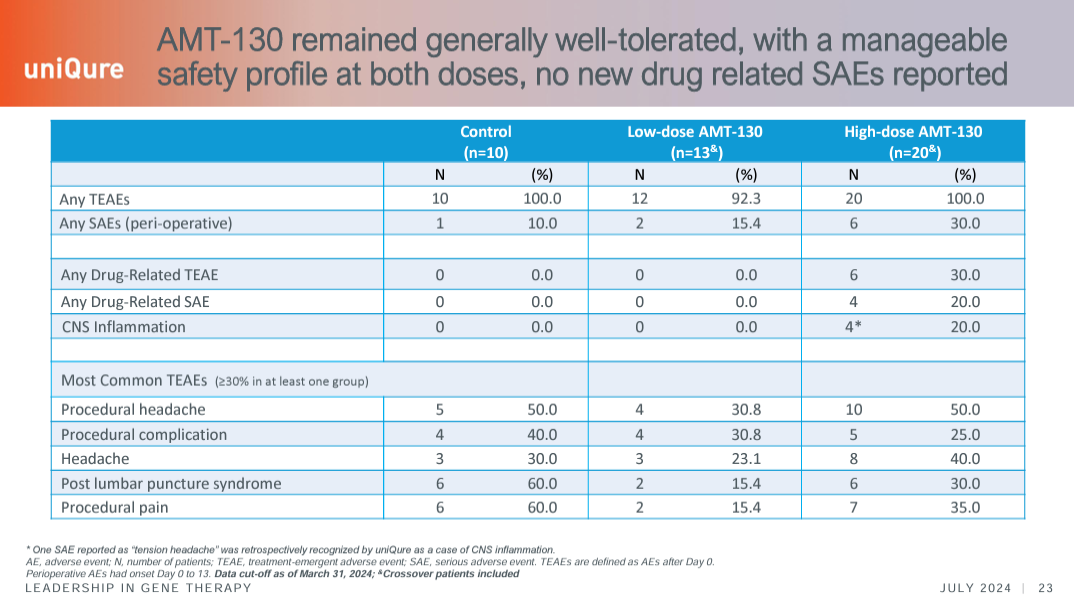
临床疗效显著:去年公布的24个月随访数据显示,接受高剂量治疗的患者疾病进展减缓80%(基于cUHDRS评分),低剂量组减缓30%。此外,患者脑脊液中的神经丝轻链(NfL,神经退行性标志物)水平平均下降11%。
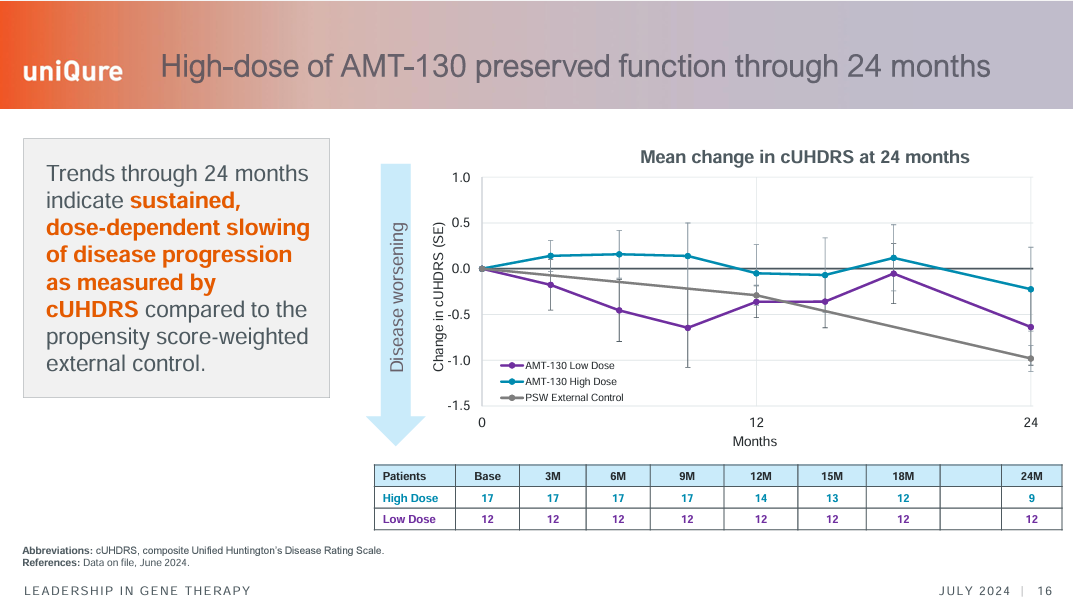
▲高剂量AMT-130显著减缓HD患者的疾病进展
安全性:尽管早期试验曾因部分患者出现严重副作用暂停,但后续数据显示AMT-130耐受性良好,未报告新的严重不良反应。
目前,已有几十名患者接受了AMT-130治疗,试验覆盖美国、欧洲多地的早期亨廷顿病患者。
市场与挑战
尽管AMT-130前景被看好,但uniQure仍面临商业化压力。公司近年通过裁员、出售资产等方式降低成本,截至2024年9月持有现金约4.35亿美元,预计可维持运营至2027年。此外,同类竞品如反义寡核苷酸药物WVE-003、小分子疗法PCT518等也在推进中,AMT-130需在疗效与安全性上持续证明优势。
结语
AMT-130的突破性疗法认定不仅是uniQure的重要里程碑,也为亨廷顿病患者社群注入信心。若后续临床数据持续积极,该疗法或将成为基因治疗领域又一标志性成果。