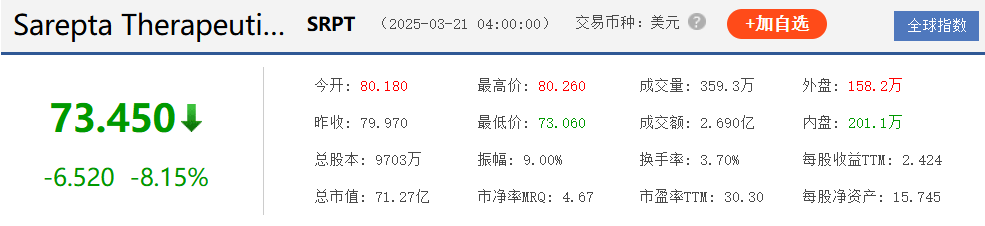
3月18日,Sarepta Therapeutics发布关于杜氏肌营养不良症(DMD)基因疗法ELEVIDYS的安全性更新,首次披露一名年轻男性患者在治疗后因急性肝衰竭(ALF)死亡。受此消息影响,该公司当日股价暴跌27%,目前总市值约71.27亿。
Sarepta 在社区声明信中表示,急性肝损伤是 ELEVIDYS 和其他腺相关病毒(AAV)介导基因疗法已知的潜在副作用,其处方信息(即 FDA 批准的标签)和《护理人员治疗指南》中已明确标注。尽管这并非新的安全信号,且 ELEVIDYS 的风险 / 获益比仍为正向,但此次急性肝衰竭(ALF)导致死亡的案例体现了该药物此前未报告过的急性肝损伤严重程度。截至目前,ELEVIDYS已在临床试验或处方治疗中用于800多名患者。
此外,检测显示该患者近期感染了巨细胞病毒(CMV),主治医生认为这可能是诱因之一。CMV 可感染并损害肝脏,引发 CMV 肝炎。

杜氏肌营养不良症(DuchenneMuscularDystrophy,DMD),是一种罕见的隐性遗传神经肌肉疾病,是所有肌营养不良中发病率最高、病情最为严重的一种类型。患者因抗肌萎缩蛋白缺失,肌肉逐渐退化,多数在20岁前因呼吸衰竭离世。
以往糖皮质激素治疗作为DMD患者的经典疗法,常见用药包括泼尼松、甲泼尼龙片和地夫可特,但激素药物大多存在较大的副作用,因此临床需求仍然存在未被满足的缺口,直至基因疗法的出现,被视为改写命运的终极答案。
Elevidys是全球首个DMD基因疗法。2023年6月,FDA通过加速审批途径批准Elevidys用于4-5岁可行走DMD患者;2024年6月,Elevidys适应症扩展至4岁以上患者适用人群扩大至约80%的DMD患者。
Sarepta将Elevidys的价格设定为每剂310万美元,2024年,该药物年销售额为8.21亿美元。在今年的JPM大会上,Sarepta还预计Elevidys全年销售额将达到29-31亿美元。

在获批前,Elevidys就存在争议。其关键指标——运动功能评分(NSAA)仅提升了2.6分(p=0.08),而安慰剂组提升了1.9分,两组之间仅相差0.65分,这一差异没有统计学意义。当时,FDA专家委员会的投票结果也接近,以8票赞成、6票反对的微弱优势才得以通过。
Elevidys并非首个与死亡事件关联的杜氏肌营养不良疗法。2021年,辉瑞因一名患者死亡暂停其基因疗法PF-06939926(后更名为fordadistrogene movaparvovec)的Ⅰb期试验。2024年3月,该疗法在Ⅱ期DAYLIGHT试验中再致一例死亡,随后Ⅲ期CIFFREO试验因疗效未达预期被终止。Elevidys的死亡病例引发关注,AAV载体相关的肝毒性问题再次凸显。
国际DMD协会声明强调:“我们必须在追求治愈的路上保持清醒——不能让孩子成为技术冒险的代价,也不能让恐惧扼杀希望。”