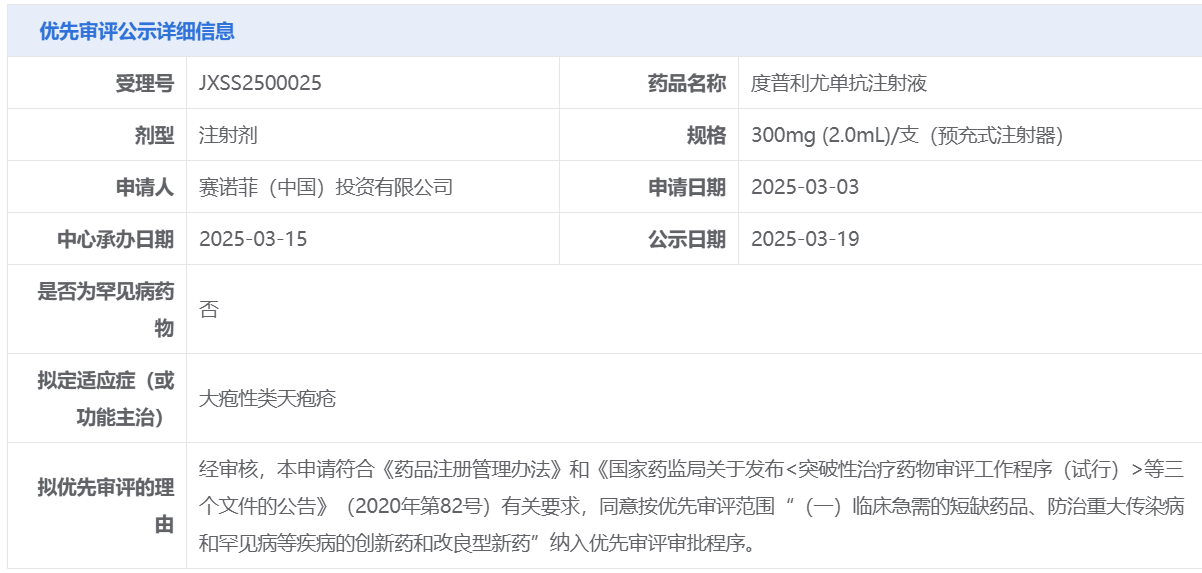
今年3月,再生元和赛诺菲在2025年美国皮肤科学会(AAD)年会上公布了关键性2/3期临床试验ADEPT结果。ADEPT试验共招募106例中重度BP成人患者,患者在接受口服皮质类固醇(OCS)治疗的基础上,被随机分为每两周接受度普利尤单抗(n=53)或安慰剂(n=53)治疗。持续疾病缓解的定义为在16周内完成OCS递减方案且无复发,同时在36周治疗期间未使用补救治疗。
在36周时,度普利尤单抗治疗组患者与安慰剂组相比的结果如下:
-
20%患者实现了持续疾病缓解,而安慰剂组这一数值仅为4%;
-
40%患者的疾病严重程度下降≥90%,而安慰剂组为10%;
-
40%患者实现了具有临床意义的瘙痒减轻,而安慰剂组为11%;
-
度普利尤单抗治疗组平均累计OCS暴露量减少1678 mg,补救药物使用风险降低54%。
-
在这一老年人群中,度普利尤单抗组与安慰剂组的不良事件总体发生率均为96%(n=51)。度普利尤单抗组中无因不良事件导致死亡,而安慰剂组有2例因不良事件导致死亡。
公开资料显示,度普利尤单抗已在全球60多个国家和地区获得一种或多种适应症的监管批准,包括各年龄段的特应性皮炎(AD)、哮喘、慢性鼻窦炎伴鼻息肉(CRSwNP)、嗜酸性食管炎(EoE)、结节性痒疹(PN)、慢性自发性荨麻疹(CSU)和慢性阻塞性肺疾病(COPD)。在中国,度普利尤单抗最早于2020年6月获NMPA批准,用于治疗成人中重度特应性皮炎,此后该产品陆续在中国获批治疗6岁及以上且小于12岁的儿童和成人中重度特应性皮炎、6个月至5岁婴幼儿中重度特应性皮炎,以及治疗成人结节性痒疹、12岁及以上青少年和成人哮喘患者的维持治疗、血嗜酸性粒细胞升高且控制不佳的慢阻肺病成人患者。
本次度普利尤单抗针对新适应症在中国拟纳入优先审评,意味着该产品有望加速惠及更多患者。
参考资料:
[1]中国国家药监局药品审评中心(CDE)官网. Retrieved Mar 19,2025, From https://www.cde.org.cn/main/xxgk/listpage/4b5255eb0a84820cef4ca3e8b6bbe20c
[2]全球领先!首个且唯一慢阻肺病靶向治疗药物达必妥®在华获批. Retrieved Sep 27,2024. From https://mp.weixin.qq.com/s/z0RmxxyPeVdDFPX5wJYjlA
[3] Dupixent® (dupilumab) Late-Breaking Positive Pivotal Data in Bullous Pemphigoid Presented at AAD. Retrieved March 10, 2025, from https://www.globenewswire.com/news-release/2025/03/08/3039374/0/en/Dupixent-dupilumab-Late-Breaking-Positive-Pivotal-Data-in-Bullous-Pemphigoid-Presented-at-AAD.html