前不久,Savara公司向美国食品药品监督管理局(FDA)提交了MOLBREEVI的生物制品许可申请(BLA),用于肺泡蛋白质沉积症(Autoimmune Pulmonary Alveolar Proteinosis,aPAP)治疗,这是一种慢性且使人虚弱的罕见肺病,其特征是肺泡中表面活性剂的异常积聚。
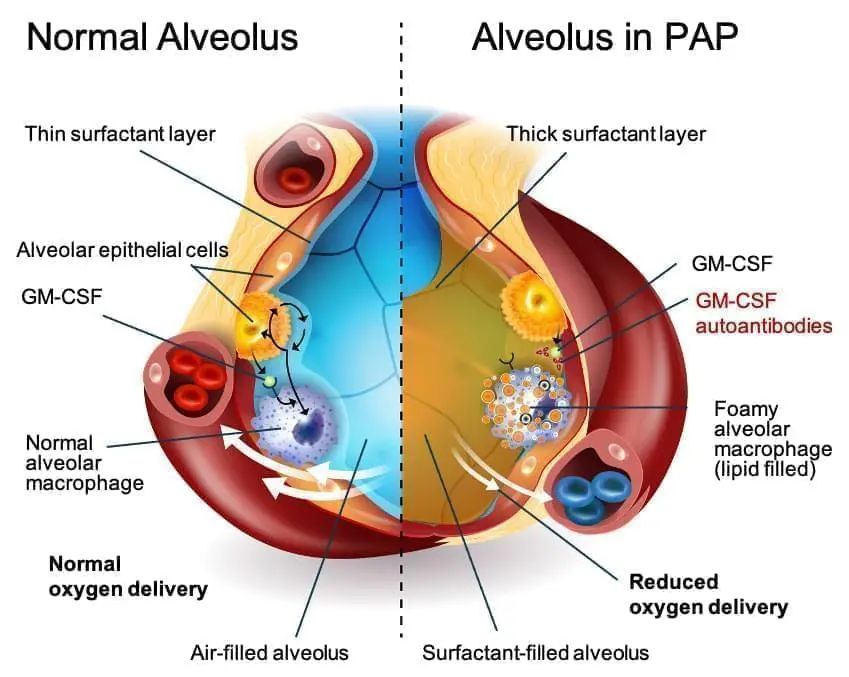
图:Savara官网
MOLBREEVI于2019年被授予快速通道和突破性疗法资格认定,用于治疗aPAP患者。因此,公司可以在BLA的单个模块完成时提交,而不需要在所有模块都完成后再等待提交申请。提交完成后,公司可要求优先审评BLA。
Savara主席兼首席执行官Matt Pauls表示:“鉴于关键性3期试验IMPALA-2的积极结果,我们认为MOLBREEVI显示出良好的效益风险状况,并可能从根本上改变aPAP的治疗方式。BLA的启动是潜在解决aPAP未满足需求的重要里程碑,美国和欧洲没有批准的药物。我们期待在整个审评过程中与FDA密切合作,并有望在2025年第一季度末完成滚动BLA的提交。”
除了快速通道和突破性疗法资格认定外,MOLBREEVI还被美国食品药品监督管理局和欧洲药品管理局(EMA)授予治疗aPAP的孤儿药资格认定,被英国药品和保健品监管局(MHRA)授予创新护照(IP)和有前景的创新药物(PIM)资格认定。
|关于自身免疫性PAP
自身免疫性PAP是一种罕见的肺部疾病,其特征是肺泡(或气囊)中表面活性剂的异常积聚。表面活性剂由蛋白质和脂质组成,是一种重要的生理物质,排列在肺泡内以防止肺泡塌陷。在健康的肺部,多余的表面活性剂被称为肺泡巨噬细胞的免疫细胞清除和消化。肺泡巨噬细胞需要粒细胞-巨噬细胞集落刺激因子(GM-CSF)刺激才能正常清除表面活性剂,但在aPAP中,GM-CSF被抗GM-CSF抗体中和,使巨噬细胞无法充分清除表面活性因子。因此,肺泡中积聚了过量的表面活性剂,导致气体交换受损,从而导致呼吸急促的临床症状,通常伴有咳嗽和频繁疲劳。患者还可能出现发烧、胸痛或咳血,特别是在继发性肺部感染的情况下。从长远来看,这种疾病可能会导致严重的并发症,包括肺纤维化和肺移植。
原文标题:
Savara Initiates Rolling Submission of a Biologics License Application (BLA) to the U.S. Food and Drug Administration (FDA) for MOLBREEVI* for the Potential Treatment of Autoimmune Pulmonary Alveolar Proteinosis (aPAP)