新年伊始,Neurogene 公司通过官网发布了其 NGN-401 I/II 期临床试验的最新调整与计划。这些调整涉及剂量组试验的优化和入组标准的修改,以下是调整的主要内容:
1、 停止高剂量组试验
2024 年第三季度,三名患者参与了 NGN-401 高剂量组的治疗。尽管前两名患者没有出现严重的不良事件,但第三名患者在给药一周后出现严重免疫反应,并于两周后不幸离世。这一事件引发了美国 FDA 对安全性数据的审查。最终,FDA 批准继续开展低剂量组的 I/II 期临床试验,但要求终止高剂量组试验。(相关信息参见:NGN-401基因疗法临床试验受试者不幸去世)
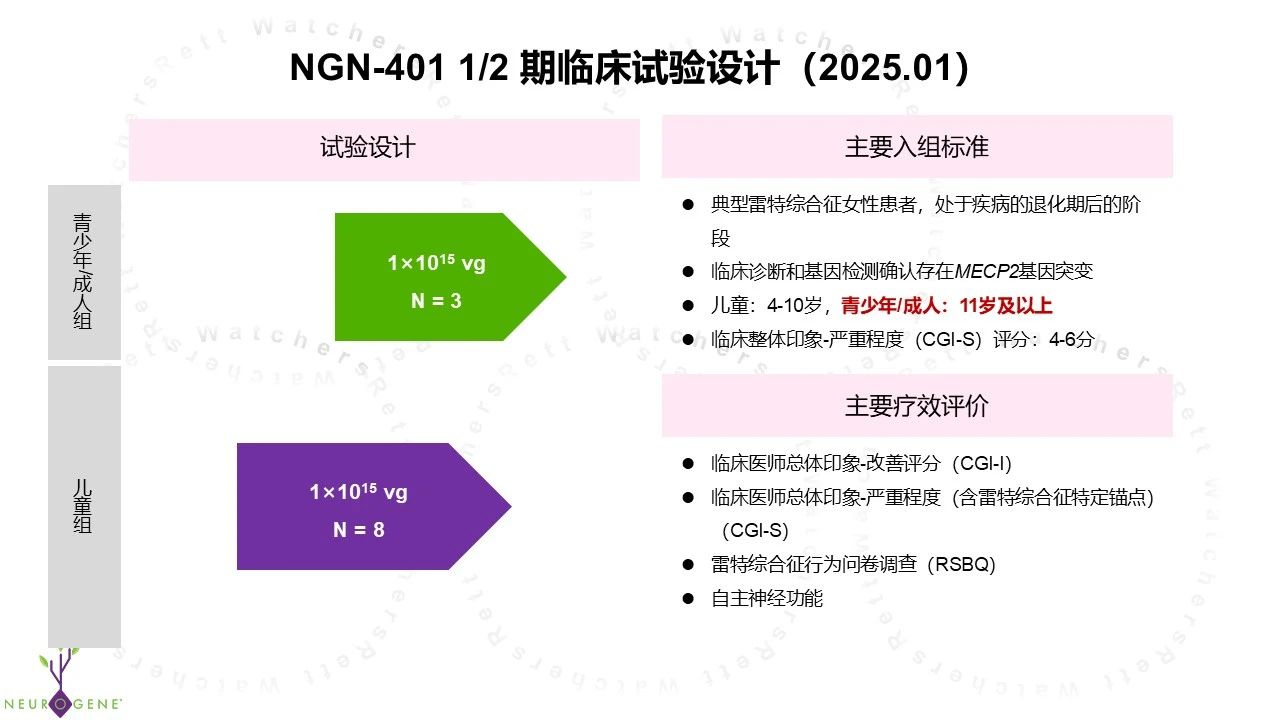
2、 调整青少年/成人组入组年龄
原先 NGN-401 I/II 期临床试验中,青少年/成人组的入组年龄为 16 岁及以上,给药剂量为 3E15 vg。根据最新调整,入组年龄下调至 11 岁及以上,给药剂量减至 1E15 vg。这一改动使得临床试验覆盖的年龄范围进一步扩大,将 11 岁至 15 岁这个年龄段患者群体一并纳入招募范围。
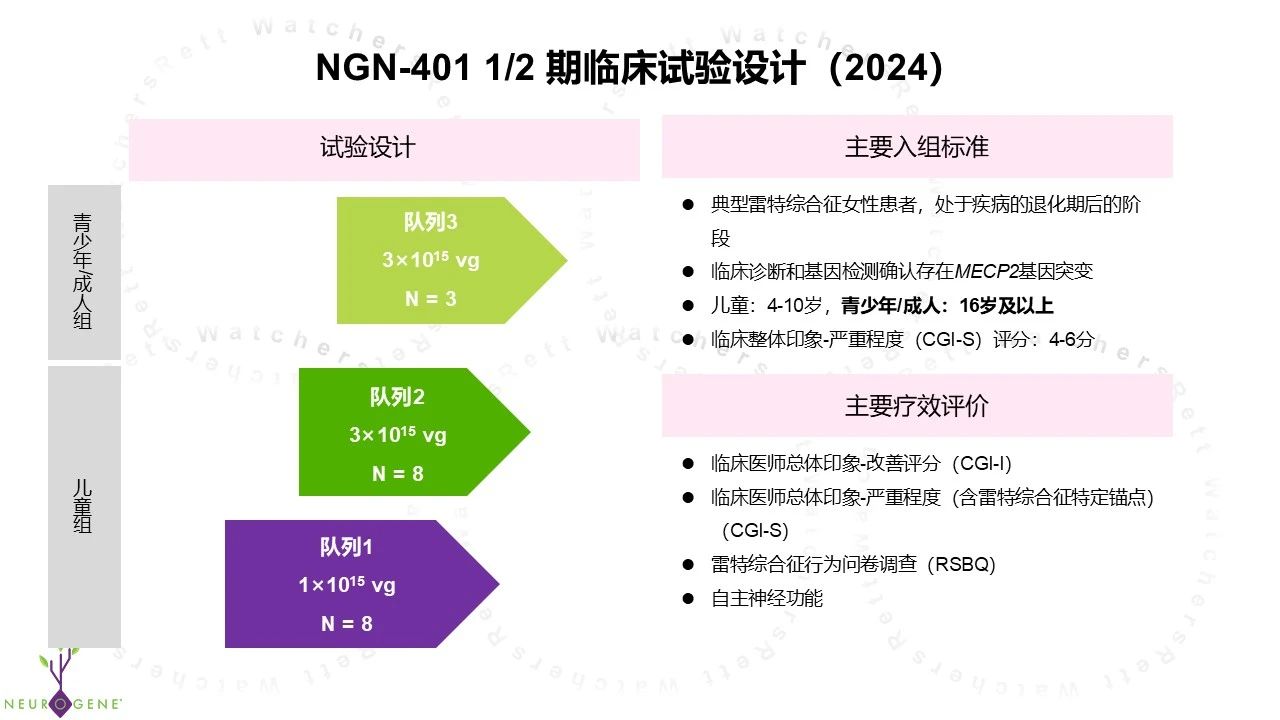
图 1:调整前方案(源自官网)
回顾 2024 年:试验成果与突破
2024 年,Neurogene 公司为共计 8 名雷特综合征患者完成了治疗,其中低剂量组 5 人,高剂量组 3 人。低剂量组的前四名患者中期数据显示,这些患者在临床医生和照护者评估的多项量表上均表现出症状改善的迹象。这些改善包括自然病程中极为罕见的复杂技能提升,以及退化后重新习得某些技能。
同时,NGN-401 项目在 2024 年取得了多个重要里程碑,先后入选美国 FDA 的 START 试点计划,并获得了 RMAT(再生医学先进疗法)认定。
展望 2025 年
Neurogene 公司表示,将借助 START 和 RMAT 的优势,加强与 FDA 的沟通,并加速注册审批流程。此外,与 FDA 就效价测定策略达成一致,将在休斯顿工厂启动生产规模扩展计划,为未来的商业化上市铺平道路。
随着 Neurogene 不断推进 NGN-401 的研究,我们期待在 2025 年看到更多关于该疗法安全性与有效性的详尽数据与成果,为罕见病患者带来新的希望。