ocrelizumab 通过 CD20靶向耗竭成功减少原发性进行性多发性硬化症 (PPMS) 中确诊的残疾积累,这表明 B 细胞是 PPMS 发病机制的致病因素。本综述探讨了 B 细胞导致 PPMS 疾病进展的可能机制,特别是探讨了细胞因子的产生、抗原呈递和抗体合成。B 细胞可能通过细胞因子的产生(特别是 GM-CSF 和 IL-6)促进 PPMS 的疾病进展,它们可以驱动初始 T 细胞分化为促炎性 Th1/Th17 细胞。细胞因子 LT-α 的 B 细胞产生可诱导滤泡树突状细胞产生 CXCL13,并间接导致 T 细胞和B 细胞浸润到 CNS。相比之下,B 细胞产生 IL-10 可能会诱导抗炎作用,这可能在减少 PPMS 中的神经炎症中发挥作用。因此,IL-10 产生减少可能导致疾病恶化。B 细胞也能够进行有效的抗原呈递,并可能通过同源相互作用诱导促炎性 T 细胞分化。B 细胞也可能通过抗体合成促进疾病活动,尽管 ocrelizumab 在 PPMS 中的益处不太可能通过抗体减少来实现。最后,各种 B 细胞亚群可能在 MS 中产生促炎或抗炎作用。
介绍
多发性硬化症 (MS) 是中枢神经系统 (CNS) 最普遍的慢性脱髓鞘疾病,影响全球 200 多万人,美国 700,000 多人 (1)。MS 有多种不同的亚型。最常见的是影响绝大多数 MS 患者的复发缓解型 MS (RRMS) 亚型。大约 85-90% 的患者患有 RRMS (2),其特征是神经功能缺损复发然后缓解,复发之间没有进行性残疾。在后期,RRMS 患者可能表现出持续恶化而没有明显缓解,称为继发性进展型 MS (SPMS)。大约36-60% 的首次发展为 RRMS 的患者在发病后平均 10年会继续发展为 SPMS (3, 4)。原发性进行性 MS (PPMS) 是一种不太常见的亚型,其特征是神经功能从疾病发作开始逐渐恶化,没有缓解的证据。大约 10-15% 的 MS 患者患有 PPMS(2)。在所有 MS 亚型中,PPMS的预后更差,与 RRMS 和 SPMS 患者相比,患者的残疾程度要高得多(5)。导致 MS 亚型中这些不同临床表型的病理生理机制是一个正在进行的研究领域。MS 的病理标志是炎症、脱髓鞘、髓鞘再生和神经变性,这些变化发生在大脑和脊髓中,要么是局灶性还是弥漫性 (6)。这些特征存在于所有 MS 亚型中,尽管与 RRMS 相比,PPMS 和 SPMS 中以弥漫性低水平炎症、缓慢扩大的预先存在的病变和更完整的血脑屏障为主(7)。
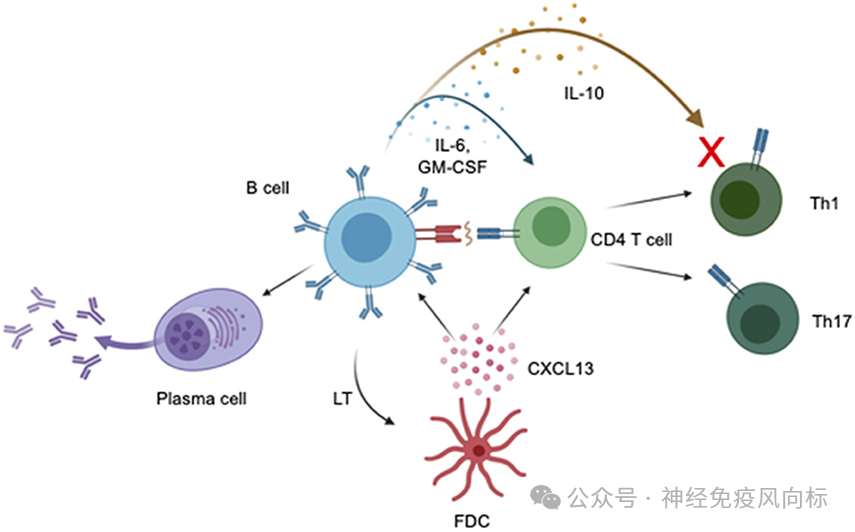
图 1.B 细胞对 PPMS 发病机制的影响。细胞因子的产生会影响 CD4 T 细胞的功能,包括促进和抑制炎症。细胞因子 IL-6 和 GM-CSF 的产生可诱导 CD4 T 细胞分化为 Th1 和Th17 T 细胞,从而导致 CNS 损伤。细胞因子IL-10 被认为可以降低 Th1 效应 T 细胞的活性并减少 EAE 和 MS 的神经炎症。B 细胞产生 IL-10 的减少可能导致 MS 的神经炎症增加。B 细胞通过 MHCII、抗原、 和 T细胞受体。B 细胞能够分化成分泌抗体的细胞,这些细胞产生能够直接破坏 CNS 的抗体。滤泡树突状细胞结合淋巴毒素 (LT) 会诱导 CXCL13 的分泌,CXCL13 可能作为 B 细胞和 T 细胞的趋化剂,增加淋巴细胞浸润到 CNS。使用 BioRender.com 创建。
B 细胞通过寡克隆带的存在和诊断意义 (8-11)、MS 患者外周和 CNS 中独特 B 细胞亚群浓度的增加(12-15) 以及 CNS 异位淋巴滤泡的形成(16-18) 与 MS 的病理学有关。B 细胞可能通过细胞因子产生、抗原呈递和抗体合成促进 PPMS 的疾病进展。B 细胞在 PPMS 免疫发病机制中的作用机制总结如图 1 所示。此外,B 细胞在MS 中的作用可能是亚群依赖性的,一些 B 细胞发挥抗炎作用 (19-21),而另一些 B 细胞则发挥促炎作用 (22, 23)。临床试验数据支持各种 B细胞亚群对 MS 的影响,该数据表明接受抗 CD20 抗体治疗的 RRMS 患者的复发率降低 (24),浆细胞和晚期 B 细胞耗竭后的复发率增加 (23)。在 PPMS 中,ocrelizumab 在减少残疾进展方面的成功可能是 PPMS 患者选择性耗竭促炎 B 细胞亚群的结果,MRI 证据显示有临床意义的持续炎症
进行性 MS 病理学和临床特征
PPMS 和 SPMS 的病理特征是广泛的弥漫性炎症伴缓慢扩大的病变、丰富的皮质脱髓鞘、脑萎缩以及正常白质中的淋巴细胞浸润和小胶质细胞激活(25)。相比之下,RRMS 的典型特征是 CNS 白质中新的和活动性局灶性炎性脱髓鞘病变。PPMS 和 SPMS 的致病机制尚不完全清楚,目前尚不清楚这些疾病亚型是否由相似或独特的致病机制引起 (26)。人们越来越认识到复发和 MRI 识别的病变活动也发生在一些 PPMS 和 SPMS 患者中,通常在疾病的早期阶段,导致进行性多发性硬化症的表型类别的改变 (27)。最近的 PPMS 和 SPMS 诊断指南现在包括两个限定词:(1) 有或没有疾病活动,由 MRI 或炎症病变或复发的临床证据定义;(2) 伴或不伴进展,定义为独立于复发的逐渐恶化的残疾 (27)。不同疾病亚型之间存在多个临床和病理重叠领域,这导致研究人员假设两种不同但相关的病理生理机制正在驱动这些 MS 亚型中的表型差异 (28, 29)。更具体地说,一个新兴的概念是 RRMS 的特征性复发和缓解是由自身反应性效应T细胞驱动的炎症过程引起的,而 SPMS 和 PPMS 的特征是残疾的进行性积累而没有缓解,是由先天免疫系统和 B 细胞功能障碍驱动的神经退行性过程的结果(30)。
现在有 20 多种 FDA 批准的 MS 疾病修饰剂,其中一种被 FDA 指定为 PPMS 的有效选择。Ocrelizumab 是唯一获得 FDA 批准的 PPMS 药物,于 2017 年初获得批准 (31)。Ocrelizumab是一种靶向 CD20 的单克隆抗体,CD20 是一种主要存在于 B 细胞上的细胞标志物 (24)。ocrelizumab 的作用机制被认为主要是通过选择性耗竭 B 细胞来抗炎。在一项针对 PPMS 患者的随机双盲、安慰剂对照试验中,ocrelizumab 减少了确诊残疾,定义为扩展残疾状况量表 (EDSS) 进展缓慢 (31)。在此之前,许多其他获准用于治疗 RRMS 的免疫靶向治疗药物已在 PPMS 中进行了试验,但未成功。干扰素 β-1a (32) 和 β-1b(33) 、芬戈莫德 (34)、利妥昔单抗 (35) 和醋酸格拉替雷 (36) 对减少PPMS 中的残疾积累无效。屈大麻酚 (37) 和高剂量生物素 (38) 也
在 PPMS 和 SPMS 中进行了试验,希望这些药物能够促进神经保护和修复。屈大麻酚在疾病恶化方面没有显着变化,而在一项随机双盲安慰剂对照研究中,高剂量生物素显示 12.6% 的患者残疾改善,而安慰剂组为 0% [38]。然而,高剂量生物素治
疗 PPMS 和 SPMS 的 III 期临床试验表明,高剂量生物素未能达到其主要和次要终点,包括残疾改善或残疾进展 (39)。正在研究生物素在进行性 MS 中发挥有益作用的机制 (40)。特立氟胺 (41)、那他珠单抗 (42)、阿仑单抗 (43)、米托蒽醌 (44) 和造血骨髓移植 (45, 46) 也被发现会改变 MS 患者的 B 细胞,但尚未在PPMS 的大规模临床试验中进行测试。目前尚不清楚 PPMS 在病理机理上是否与 RRMS 和 SPMS 不同,但从其他疾病缓解疗法失败的背景来看,Ocrelizumab 在 PPMS 中的临床成功意味着 PPMS 的疾病机制存在差异。本文将探讨 B 细胞耗竭在 PPMS 中产生治疗效果的机制或机制。
B 细胞在 PPMS 中致病作用的证据
寡克隆条带
长期以来,独特的寡克隆带 (OCB) 的存在和抗原经验 B 细胞鞘内 IgG 合成的增加一直被认为是 MS 的一个组分 (47)。在~95% 的首次就诊时可检测到 OCB,随后继续发展为 MS。此外,OCB 在确定从 CIS 进展为多发性硬化症和残疾累积的可能性方面可能具有预后价值 (9-11)。MS 患者分离的 CNS 免疫球蛋白中可变基因片段的优先表达表明,CNS 中存在的免疫球蛋白已经经历亲和成熟,这可能是由特定抗原的存在驱动的(48, 49)。患有OCB 的 MS 患者的病程比没有 OCB 的 MS 患者更具侵袭性 (50)。此外,在疾病进展的患者中,CSF 中的寡克隆 IgM 带与更快地进展为 SPMS(51, 52) 和 PPMS 中的活动性炎症有关 (53)。这些发现表明鞘内免疫球蛋白在MS 中具有潜在的致病作用。
CSF 和外周血中的 B 细胞
在健康患者中,在 CSF 中几乎检测不到 B 细胞,而在 MS 中,CSF 白细胞中 B 细胞的平均频率约为 5% (12, 13)。与外周的 B 细胞相比,CNS 中的大多数 B 细胞是记忆 B 细胞,通过 CD27 的表面表达来识别。在 RRMS 患者中,MRI 显示神经退行性变特征的增加与外周 B 细胞数量的增加和活化 B 细胞比例的增加相关 (14)。SPMS患者的外周血中含有大量特异性 B 细胞群,尤其是DC-SIGN+ B 细胞和 CD83+ B 细胞 (54),这与疾病进展相关。另一项研究发现,与 SPMS、RRMS 或健康对照患者相比,PPMS 患者在外周表达 TNFα 的CD19+ B 淋巴细胞增加 (15)。来自 RRMS 和 SPMS 患者的 CD19+ B 淋巴细胞显示 p65 的高磷酸化 (55),但这种多活跃度尚未在 PPMS 中得到证实。此外,与健康对照相比,所有 MS 亚型中产生 IL-13、IL-10 和 TGF-β 的抗炎“调节性 B 细胞”均减少。多项研究报道了 CSF 和外周免疫细胞表型的流式细胞术特征,这为导致 MS 中 B 细胞增殖和激活的可能潜在机制提供了见解。总体而言,PPMS 和 SPMS 患者 CSF 和外周活化 B 细胞的数量增加,所有形式的 MS 中缺乏调节性 B 细胞, SPMS 患者 B 细胞群增加与疾病进展的相关性表明 B 细胞在进行性 MS 的病理学中具有独特的作用。
异位淋巴滤泡
中枢神经系统通过血脑屏障(BBB)与外周循环物理分离,血脑屏障(BBB)将中枢神经系统区分开来并限制白细胞迁移到大脑和脊髓中。从历史上看,CNS 被认为是一个免疫特权位点,但最近的证据表明,记忆 T 细胞在外周和 CNS 之间稳定地运输 (56)。据推测,记忆 T 细胞使用特异性粘附分子、趋化因子和趋化因子受体进入 CSF,并通过脉络丛的上皮进入 CSF (56)。然后,这些记忆 T 细胞在CSF 中循环,并与软脑膜周围蛛网膜下腔内的 CNS 髓样抗原呈递细胞 (APC) 相互作用,在那里它们可能会传播免疫反应。在 RRMS、SPMS 和 PPMS 患者的软脑膜中观察到不同的免疫细胞浸润 (17, 18)。许多研究将这些免疫细胞浸润与相邻皮层的脱髓鞘和神经元变性联系起来 (18, 57),导致研究人员假设软脑膜炎症是 MS 疾病进展的潜在驱动因素 (16)。软脑膜炎症的谱系表现出显著的变异性,从一些患者杂乱无章的免疫细胞集合到其他患者免疫细胞组织有序的集合,具有许多类似于淋巴组织的特征 (58)。这些组织良好的免疫细胞结构被称为异位淋巴滤泡样结构 (ELF),其特征是独立的 B 细胞和 T 细胞区域、滤泡树突状细胞、浆细胞和增殖的 B 细胞网络,并有证据表明正在进行生发中心反应(59)。虽然这些 ELF 在 MS 患者中的真实发生率和意义仍在受到严格审查,但它们在进行性 MS 中并不少见。一项尸检研究发现,高达 40% 的 SPMS 患者脑膜中存在ELF 的证据,但在 RRMS 或 PPMS 中没有证据(59)。对 MS 患者的进一步尸检系列支持 SPMS 患者存在脑膜 ELF (17)。值得注意的是,ELF 的存在与皮质脱髓鞘增加有关 (17)。
专门针对 PPMS 的进一步研究没有发现 ELF 的证据,而是有证据证明更广泛的紊乱的软脑膜炎症 (16)。在一项包含 26 例 PPMS 患者的尸检系列研究中,未检测到 ELF 的正式组织;然而,一部分PPMS 患者有广泛的脑膜免疫细胞浸润,由 B 细胞和 T 细胞组成。有广泛软脑膜炎症证据的患者临床病程更严重,皮质脱髓鞘增加。进一步的研究证实了这些发现,并证明了 SPMS 患者存在 ELFs,而PPMS 和 RRMS 患者存在全身性软脑膜炎症 (60)。有趣的是,在进行性患者中,软脑膜炎症仅存在于病理活动性疾病患者中,这些疾病定义为在尸检时存在经典活动性或缓慢扩大的病变。病理上非活动性斑块的患者不表现出软脑膜炎症的特征 (60)。软脑膜免疫细胞浸润的组成因疾病亚型而异,PPMS 或 SPMS 患者的浆细胞患病率增加。此外,病理性非活动性疾病的进行性患者的总体软脑膜炎症水平与健康对照相似,但仍具有适度但显着较高的浆细胞和总体 B 细胞数量 (60)。鉴于软脑膜炎症在患有活动性疾病的 PPMS 患者亚群中更为普遍,并且可以在 MRI 上可视化(60, 61),可以作为潜在的生物标志物来识别可能从 B 细胞治疗中受益最大的 PPMS 患者。
鉴于 SPMS 中的 ELF 与 PPMS 中广泛杂乱无章的软脑膜炎症与邻近皮质病变之间的相关性,软脑膜炎症可能是残疾的独立驱动因素,尤其是在进行性 MS 中 (16, 17)。然而,软脑膜炎症在 MS 发病机制中的具体作用仍然是一个积极争论的领域。一些研究描述了 PPMS 和 SPMS 患者的广泛软脑膜下脱髓鞘,但没有令人信服的 ELF 或 B 细胞浸润证据 (62)。这似乎表明,在这些患者中观察到的皮质脱髓鞘可能不需要 ELF 或 B 细胞的软脑膜炎症。此外,鉴于大多数关于 MS 软脑膜炎症的研究数据来自尸检系列,软脑膜炎症可能是对原发性皮层脱髓鞘的继发反应,而不是致病因素的可能性仍然存在。
B 细胞介导的 PPMS 疾病进展的作用机制
抗体生产
MS 患者 CSF 中存在独特的寡克隆带,这导致了 B 细胞可能通过自身抗体介导的 CNS 组织损伤直接导致 MS 发病机制的假设 (47)。MS 患者中存在的 CNS B 细胞克隆群支持了这一观点,这些克隆群显示出体细胞超突变和抗原驱动的亲和力成熟的证据 (48, 49)。此外,从 MS 患者的 CSF 中分离的浆细胞会产生构成寡克隆带的抗体 (63)。与 RRMS 患者相比,SPMS 和 PPMS 患者在血管周围和脑膜免疫细胞浸润中的浆细胞数量更高,表明浆细胞在疾病进展中具有独特的作用(60)。探索抗体在 MS 发病机制中作用的早期研究表明,在尸检和EAE的狨猴模型中,急性MS病变中与崩解髓鞘结合的抗体[64]。与髓鞘结合的免疫球蛋白可通过补体激活 (65)、通过激活 Fc 受体激活小胶质细胞/巨噬细胞 (66)、少突胶质细胞生理学紊乱 (67) 或髓鞘碱性蛋白的蛋白水解活性 (68) 诱导组织损伤。此外,PPMS 和 SPMS 患者的抗体分泌浆细胞数量随着年龄的增长而增加 (60)。总体而言,这些数据表明 CNS 浆细胞抗体的产生可能在 PPMS 疾病进展中发挥作用。
应该强调的是,尚未鉴定出特异性自身抗原已被一致验证为 MS 中的自身抗体靶标 (69)。支持鞘内抗体介导损伤的证据来自一项涉及 Ig 从 PPMS 患者脑脊液过继转移给幼稚小鼠的研究。这些小鼠死于与 CNS 病理平行的运动缺陷,包括脊髓内的脱髓鞘和轴突丢失 (70)。许多潜在的自身抗原与 PPMS 患者存在特异性自身抗体有关。PPMS 中自身抗体的候选靶标包括抗神经丝光 (71)、抗神经节苷脂 GM3 (72) 和抗 SPAG16 (54)。然而,这些抗体尚未在大量 PPMS 患者中可靠检测到,损伤的因果机制也尚未明确。在一项针对所有 MS 亚型患者的研究中,在大约一半的受试者中发现了 KIR4.1 特异性抗体(一种主要在神经胶质细胞上表达的 ATP 敏感向内整流钾通道)。然而,抗 KIR4.1 抗体的存在与特定的 MS 表型 (73) 不对应,随后的研究未能重现这些发现 (74)。总体而言,虽然已在 PPMS 患者中发现了许多自身抗体,但没有特异性自身抗体与 CNS 损伤可靠相关。
MS 患者抗 CD20 治疗的临床数据反对治疗获益与抗体产生之间的联系。B 细胞在发育成浆细胞时下调 CD20 表达,因此分泌抗体的成熟浆细胞不表达 CD20 (75)。因此,ocrelizumab或利妥昔单抗不直接靶向浆细胞,抗 CD20 疗法不太可能对鞘内抗体水平产生直接影响,至少在短期内是这样。接受利妥昔单抗治疗的 MS 患者血清总抗体水平缺乏可测量的变化支持了这一点,即使在那些获得临床益处的患者中也是如此 (76)。专门评估利妥昔单抗对抗体水平影响的其他临床研究证实,利妥昔单抗不会改变外周抗体水平 (77)。此外,即使在存在耗尽的 CSF B 和 T 细胞的情况下,接受利妥昔单抗治疗的 RRMS 患者的 CSF IgG 水平、IgG 指数和寡克隆带数也保持不变 (78)。鉴于抗 CD20 疗法会耗尽绝大多数浆细胞前体细胞,长期靶向 CD20 的 B 细胞耗竭疗法可能会影响接受治疗的患者的浆细胞,从而改变抗体水平,但抗体调节似乎无助于 MS 治疗后不久看到的临床益处。
细胞因子产生
B 细胞根据不同的细胞因子产生而发挥促炎和抗炎作用 (79)。B 细胞能够控制效应 T 细胞反应的极化和通过细胞因子分泌形成记忆 T 细胞 (79)。B 细胞的一个亚群通过分泌 IL-10、TGF-β 和 IL-35表现出抗炎特性。这些独特的 B 细胞由 CD 标志物 CD19 和 CD138 识别,由于它们在这些抗炎细胞因子的产生中的作用,因此被称为“调节性 B 细胞” (79, 80)。B 细胞还产生细胞因子,诱导 T 细胞分化为 Th1、Th2 或 Th17 亚型 (81),并在小鼠自身免疫模型中发挥抗炎作用 (80)。
RRMS 和 SPMS 患者的细胞因子网络失调,特别表明抗炎细胞因子 IL-10 减少 (82)。从RRMS 和 SPMS 个体中分离的 B 细胞(尤其是记忆 B 细胞)也可以被激活,产生异常大量的细胞因子 TNF-α、LT-α、IL-6 和 GM-CSF (82, 83)。一项针对 MS 患者外周血的研究表明,由细胞表面标志物 CD19 和细胞因子 TNF-α 分泌定义的外周促炎 B 细胞在所有 MS 亚型中均显著增加,尤其是 PPMS 患者 (15)。此外,由细胞表面标志物 CD19 和细胞因子 IL-10 和TGF-β 的分泌鉴定的外周 B 调节细胞在所有 MS 亚型中均减少,尤其是 PPMS 亚型。B 细胞产生特定细胞因子的过量或不足可能在 PPMS 的发病机制中起因果作用。
LTα 的 B 细胞生产
LTα 由 B 细胞和 T 细胞分泌,膜结合的 LTα 与滤泡树突状细胞的结合会诱导 CXCL13 的产生 (84)。CXCL13是一种与趋化因子受体 CXCR5 结合的配体,趋化因子受体CXCR5 几乎在所有 B 细胞(T 细胞亚群)上表达,激活后在 T 细胞上瞬时表达 (85, 86)。CXCL13 被认为是一种有效的化学引诱剂,在 MS 的 T 细胞和 B 细胞 CNS 浸润和病变形成中起致病作用 (87),并在活动性脱髓鞘 MS 病变中局部产生 (87)。CSF CXCL13 升高也与RRMS 患者复发风险增加和不良预后相关 (88)。CSF CXCL13 水平升高会增加 CIS 转化为 MS 的可能性 (88)。在接受利妥昔单抗治疗的 RRMS 患者中,趋化因子 CXCL13 水平降低与 T 细胞水平降低相关 (89)。这导致研究研究人员假设 B 细胞耗竭通过减少 LT α介导的滤泡树突状细胞产生 CXCL13 来诱导继发性 T 细胞耗竭。CSF 细胞因子分析还表明,与健康对照相比,PPMS 患者的 CXCL13 增加 (90)。此外,在 PPMS 患者中,发现 CSF CXCL13 与 CSF B 和 T 细胞水平相关 (91),与没有疾病活动的患者相比,在有疾病活动度的患者中发现 CXCL13 的量更高 (92)。总体而言,这些数据表明 B 细胞可能通过 LT-α 和CXCL13 在 PPMS 中起致病作用,这可能通过抗CD20 疗法来缓解。
IL-6 的 B 细胞生产
小鼠 EAE 是一种常用的动物模型,已被用于破译 MS 的免疫致病机制并设计新的疗法 (93)。通过在佐剂存在下用 CNS 组织或髓鞘肽免疫小鼠或通过将脑炎 T 细胞过继转移到幼稚小鼠中来诱导 EAE。不同品系的小鼠在诱导疾病后会表现出不同的病理。SJL/J 小鼠品系在免疫时通常表现出复发缓解型脱髓鞘疾病,而 C57BL/6 小鼠则表现出单相或慢性进行性脱髓鞘疾病 (94)。后者被认为是研究 PPMS 和 SPMS 中存在的脱髓鞘和轴突损伤的合适模型,尽管小鼠和人 MS 疾病病理学之间的显着差异为解释 EAE 结果带来了明显的局限性 (94)。
EAE 小鼠的 B 细胞比幼稚小鼠产生更多的 IL-6,并且用单克隆抗 CD20 抗体处理会导致 IL-6 的 B 细胞产生正常 (95)。与没有 B 细胞 IL-6 缺失的对照小鼠相比,EAE 期间仅在 B 细胞中 IL-6 的基因缺失表明其过程更加惰性 (95)。在共培养中,B 细胞部分通过 IL-6 信号转导增强体外 Th1 和Th17 T 细胞对真菌感染的反应 (96)。此外,对PPMS 和 RRMS 患者 CSF 的分析显示,PPMS 患者的鞘内 IL-6 产生水平显着升高 (97)。最近的临床数据表明,用 ocrelizumab 治疗 PPMS 患者会导致 B 细胞产生IL-6 减少,这与 T 细胞向更具抗炎性的表型转变有关 (98)。动物和人类研究与接受 ocrelizumab 治疗的 PPMS 患者的临床数据的一致性为 IL-6 在 PPMS 发病机制中的作用提供了强有力的证据。综上所述,这些发现表明 B 细胞产生 IL-6 可以通过使 T细胞偏向促炎表型而在 PPMS 中产生炎症损伤。
IL-10 的 B 细胞生产
IL-10 是一种有效的免疫调节分子,在多种自身免疫性疾病中失调,如炎症性肠病、类风湿性关节炎和系统性红斑狼疮 (99)。在 EAE 期间,B细胞中 IL-10 的选择性基因缺失导致非缓解病程,据信这是由Th1 细胞活性增加驱动的 (100),支持 IL-10 介导的 B 细胞抗炎作用。在接受产生 IL-10 的 B 细胞的 EAE 小鼠中,疾病受到抑制 (101)。B 细胞的一个独特亚群,称为B10 细胞,可能作为炎症和自身免疫的负调节因子发挥作用 (80)。已在 PPMS、RRMS 和 SPMS 患者的外周血中分离出 B10 细胞 (102),因此假设该B 细胞群的功能缺陷可能是导致 MS 发病机制的 (82)。目前尚不清楚 B10 细胞在进行性疾病中的作用;迄今为止,在 PPMS 的研究中尚未详细说明 B10 细胞的特定功能(或缺乏功能)。鉴于 B 细胞衍生的 IL-10 在PPMS 中具有抗炎作用的证据主要来自动物研究,这些发现是否会在 PPMS 患者中观察到还有待观察,因此它在 PPMS 发病机制中的特定作用仍不清楚。
抗炎 B 细胞群的重建
除了抗 CD20 疗法对 PPMS 患者的直接影响外,治疗还可能产生更持久的效果,特别是通过重建抗炎 B 细胞群,从而进一步调节疾病进展和/或活动。用利妥昔单抗治疗 RRMS 患者会导致 B 细胞重建,产生较低水平的 GM-CSF 和更高水平的 IL-10 (83)。这表明利妥昔单抗对 MS 致病过程的免疫基础具有持久作用。这种抗炎 B 细胞重建是否发生在接受 ocrelizumab 治疗的 PPMS 患者中还有待观察。
抗原呈递至 T 细胞
B 细胞是 T 细胞的极强 APC。它们选择性地内化与表面免疫球蛋白结合的抗原,然后通过 MHC II 分子将其呈递给 T 细胞。B 细胞选择性内化和呈递所需的抗原浓度比单核细胞呈递所需的抗原浓度低 103 至 104 倍 (103),这可能使 B 细胞成为抗原水平低时 T 细胞活化所需的 APC (104)。当 B 细胞识别与 T 细胞相同的抗原时,它们也是更有效的 APC (103)。
B 细胞抗原呈递与 MS 发病机制的相关性最初在 EAE 小鼠模型中进行了探索。B 细胞上 MHC II 分子选择性缺陷的小鼠对 EAE 具有抗性 (105)。相比之下,仅在 MOG 特异性B 细胞上选择性表达 MHC II 而不表达其他 APC 的小鼠对 EAE 敏感 (105)。这表明 B 细胞在 MS 发病机制中的作用是通过 B 细胞和 T 细胞之间的同源抗原增强的抗原呈递机制。在一项探索重组 MOG 蛋白诱导的 EAE 小鼠中 B 细胞作用的研究中,该蛋白产生被认为是“B 细胞依赖性”的 EAE 小鼠模型,与用 MOG 肽残基 35-55 免疫诱导的EAE 模型相比,抗 CD20 处理对 Th1 和 Th17 亚群的减少显著增加 (106)。这表明 B 细胞通过抗原呈递可能诱导促炎极化,Th1 和 Th17 亚群增加。
B 细胞的抗原呈递功能在最近的人类研究中得到了进一步的探索。体外发现与没有风险单倍型的 RRMS 患者相比,具有 HLA-DR15+ 风险单倍型的 RRMS 患者的 T 细胞增殖增加 (107)。鉴于 HLA-DR15 基因编码不同的 MHC II,该数据导致假设具有这种单倍型的 MS 风险增加是 B 细胞抗原呈递的直接结果。该研究进一步探讨了 HLA-DR15+ 单倍型的致病性,发现 T 细胞的体外增殖依赖于与 B 细胞共培养。当 B 细胞的HLA-DR 表达被伊布替尼抑制时,T 细胞增殖减少,这意味着B 细胞激活 T 细胞的 HLA-DR 依赖性机制。此外,在接受利妥昔单抗治疗的 RRMS 患者中,T 细胞离体增殖和促炎细胞因子的产生显着减少。发现添加利妥昔单抗预处理前获得的自体 CD20 + B 细胞可恢复 CD4 + T 细胞增殖。记忆 B 细胞,特别是未转换的记忆 B 细胞,是与 T 细胞增殖最密切相关的 B 细胞群 (107)。最近的一项病理研究表明,与 RRMS 患者相比,PPMS 患者的 CNS 病灶内的 B 细胞数量更高 (108)。此外,这些病灶中 B 细胞数量较少与 CNS T 细胞浸润减少相关,临床结局更好 (108)。总体而言,这些数据表明,通过抗原呈递对 T 细胞的 B 细胞调节可能是 MS 发病机制的一个因素,记忆 B 细胞被认为是 B 细胞群通过抗原呈递对 T 细胞增殖的贡献最大。目前的研究几乎完全包括 RRMS 中的动物研究和人类研究,因此这些发现是否可以在 PPMS 中复制还有待观察。
B 细胞的促炎和抗炎作用
ocrelizumab 的临床成功以及表明不同 B 细胞群和细胞因子的促炎和抗炎作用的研究表明 B 细胞在炎症中具有多方面的作用。这一观点得到了 Atacicept 在 MS 中的促炎作用的支持,MS 是一种先前试验用于治疗 RRMS 的抗炎药 (23)。
Atacicept 是一种人重组融合蛋白,可与 BLyS(B 淋巴细胞刺激剂)和APRIL(一种 PRoliferation-诱导配体)的受体结合,作为这些配体的拮抗剂并抑制受体激活。这两种细胞因子对 B 细胞成熟、功能和存活很重要。Atacicept 对 B 细胞具有选择性作用,耗竭浆细胞和晚期 B 细胞,同时保留 B 细胞祖细胞和记忆 B 细胞 (109)。Atacicept 是唯一一种作用机制导致记忆 B 细胞相对保留的 MS 免疫疗法 (22)。
在一项针对 RRMS 患者的atacicept 的随机双盲、安慰剂对照试验中,与接受安慰剂的患者相比,接受 atacicept 的患者年化复发率更高 (23)。出于这个原因,该试验很早就暂停了,并导致了这样一种假设,即atacicept 对浆细胞的消耗和记忆 B 细胞的相对保留意味着浆细胞主要作为抗炎细胞发挥作用,而记忆 B 细胞在 MS 中起促炎作用 (13, 110)。
这一假设得到了进一步数据的支持,这些数据突出了浆细胞和记忆 B 细胞的这些不同功能。在 EAE 小鼠模型中,发现来自肠道的浆细胞通过分泌 IL-10 对 EAE 中的神经炎症起抗炎作用 (19)。这与前面提到的关于 IL-10 在 EAE 中的抗炎作用的数据相符 (101),并暗示浆细胞是负责 IL-10 分泌的 B 细胞亚型。此外,进行性多发性硬化症中鞘内浆细胞产生的免疫球蛋白可能通过与抑制性Fc 受体结合而具有直接的抗炎作用 (111)。少突胶质细胞特异性 Ig 也可能促进髓鞘再生 (112)。相比之下,记忆 B 细胞可能具有促炎作用,最近的研究表明,离体记忆 B 细胞可能在诱导 CD4+ 自身反应性方面发挥重要作用,这可能是通过抗原呈递机制 (107)。
临床证据表明 atacicept 会增加 MS 复发率,结合表明浆细胞的抗炎作用和记忆 B 细胞的促炎作用的其他发现,表明 B 细胞在 MS 中可以同时具有促炎和抗炎作用,具体取决于其特定的克隆亚群,导致疾病缓解或进展, 分别。
Ocrelizumab 治疗PPMS
在先前批准用于 RRMS 的其他抗炎药(特别是抗 CD20 单克隆抗体利妥昔单抗)失败的情况下,ocrelizumab 在减少 PPMS 残疾方面的成功引发了关于 ocrelizumab 发挥其治疗益处的具体机制的重要问题。关于 ocrelizumab 的成功和利妥昔单抗失败的一种假设源于每项研究中入组的 PPMS 患者类型的表型差异。利妥昔单抗和ocrelizumab 都是 CD20 单克隆抗体。CD20 是一种细胞表面标志物,在大多数 B 细胞亚群上表达,但早期 pro B 细胞、晚期浆母细胞和终末分化浆细胞除外 (113)。在临床试验中,ocrelizumab 而不是利妥昔单抗显着减少了 PPMS 患者的残疾进展 (31,35)。在涉及利妥昔单抗治疗 PPMS 患者的 OLYMPUS试验中,总体上未观察到疾病进展的显着减少 (35)。然而,一项亚组分析显示,年龄较小 (<51) 和 MRI 上钆增强病变的存在 (基线时 ≥1 钆增强病变) 可预测治疗反应性 (35)。特别是,与接受利妥昔单抗治疗的相同人群相比,安慰剂组具有这些特征的患者发生临床疾病进展的可能性高 3 倍 (35)。随后的 ORATORIO 试验在 PPMS 中使用 ocrelizumab 的设计招募对象相对年轻 (平均年龄 44.6 岁;最大年龄 55 岁),病程较短 (平均6.4 年;最长 15 年),并且包括相对高比例的基线时钆增强病变的参与者(26%) (31).相比之下,在之前使用利妥昔单抗、芬戈莫德和醋酸格拉替雷的 PPMS 临床试验中,任何基线钆增强的参与者百分比分别为 24.5%、13% 和 14% (34-36)。在 ORATORIO 中,基线时钆增强病变患者亚组与无增强病变的患者 (0.84 [0.62–1.13]) 的疾病进展风险降低更大(尽管差异不显著)(114)。每项研究中患者群体的这些差异导致推测,有一部分 PPMS 患者,特别是有活动性炎症证据的年轻患者,由于去除了 B 细胞介导的炎症作用,他们优先受益于 B 细胞耗竭治疗 (115)。
最近的一项回顾性研究检查了利妥昔单抗在 PPMS 治疗中的超说明书使用,发现 41.5% 接受利妥昔单抗治疗的 PPMS 患者在 3 年后出现显着的疾病进展 (116)。患者在治疗前有更高程度的炎症,基线脑部 MRI 显示 50% 的患者存在钆增强病变 (116)。相比之下,ORATORIO 在12 周时疾病进展的发生率为 32.9%,基线脑部 MRI 显示钆增强病变的发生率为 26% [31]。超说明书利妥昔单抗研究有许多局限性,包括回顾性设计,这使研究人员无法纳入对照组,以及相对较少的 PPMS 患者(总共 43 名) (116)。此外,目前尚不清楚导致超说明书使用利妥昔单抗的具体标准,并且很可能由于疾病快速进展而选择患者进行治疗,这可能导致对更具侵袭性 PPMS 的患者进行偏倚选择。尽管如此,该研究表明,尽管脑部 MRI 上有炎症证据,但仍有大量 PPMS 患者在用利妥昔单抗耗竭 B 细胞后将继续进展。
与利妥昔单抗相比,ocrelizumab 抗体结构的功能差异可能会导致更有利的安全性和耐受性,但不太可能显着改变接受治疗的 PPMS 患者外周和 CNS 中循环B 细胞的水平。利妥昔单抗是一种嵌合抗体,具有源自小鼠蛋白的 Fab 结构域,而 ocrelizumab 仅来源于人蛋白 (117)。与利妥昔单抗相比,ocrelizumab 具有结构独特的 Fc 区结构域,与自然杀伤细胞的结合具有更高的亲和力。与利妥昔单抗相比,这种差异导致 ocrelizumab 的抗体依赖性细胞毒性相对较强,而补体依赖性细胞毒性相对较弱 (24)。据推测,补体依赖性细胞毒性的这种相对降低是通过降低全身补体介导的细胞因子释放速率来降低不良反应的发生率 (118)。此外,ocrelizumab 具有独特的 Fab 结合结构域,会改变其与 CD20 的结合亲和力 (119)。与利妥昔单抗相比,ocrelizumab 表位结合亲和力的这种差异不太可能转化为循环 B 细胞耗竭增加,因为接受利妥昔单抗治疗的 PPMS 患者在利妥昔单抗治疗后第 2 周至第 96 周几乎完全耗竭循环B 细胞,定义为 CD19+ B 细胞减少 >95% (35).此外,在接受利妥昔单抗治疗的 RRMS 患者中,利妥昔单抗治疗后 24 周的 CSF B 细胞减少了90% [78]。另一项检查双静脉注射和鞘内注射利妥昔单抗对 SPMS 患者消耗 CNS B 细胞疗效的研究发现,外周 B 细胞可靠地耗尽,但 CSF B 细胞不完全和短暂地耗尽 (120)。虽然 ocrelizumab 可能比利妥昔单抗更有效地消耗 CSF B 细胞,但鉴于 ocrelizumab 是静脉内给药,它不太可能达到优于鞘内注射利妥昔单抗给药所需的 CNS 渗透。
结论
Ocrelizumab 是第一个也是唯一一个 FDA 批准的用于 PPMS 患者的疾病缓解疗法。在 ORATORIO 中接受治疗的患者的特征表明,ocrelizumab 可能发挥抗炎作用,最明显的益处发生在疾病活动倾向较高的年轻 PPMS 患者中 (114)。这一想法在 PPMS 的利妥昔单抗临床试验中得到了支持,该试验显示 MRI 上钆增强病变的年轻患者亚组有益 (35)。Ocrelizumab 可能主要通过消除 B 细胞功能(例如细胞因子产生和抗原呈递)来诱导抗炎作用。B 细胞在 MS 中表现出一系列活性,其中记忆 B 细胞起促炎作用,而 B 细胞谱系细胞的一个子集,例如浆母细胞/浆细胞片段,有助于抑制炎症。B 细胞产生的细胞因子,包括 LT-α、IL-6和 GM-CSF,被认为是 MS 中促炎作用的驱动因素,通过 T 细胞从幼稚 T 细胞分化为炎性Th1/Th17 细胞以及通过间接髓细胞刺激 T 细胞。相反,B细胞产生 IL-10 可能会在 PPMS 中引起抗炎作用。然而,目前缺乏临床人体研究来明确支持或反驳这一说法。B 细胞抗原呈递也可能通过诱导初始 T 细胞分化为 Th1/Th17 并驱动 MS 发病机制,在驱动 T 细胞活性中发挥重要作用。奥瑞珠单抗不太可能通过抗体减少对 MS 产生益处,因为在存在治疗益处的情况下,尽管 B 细胞和 T 细胞耗竭,免疫球蛋白水平仍然升高。目前尚不清楚接受 ocrelizumab 治疗的 PPMS 患者在治疗后是否会像接受利妥昔单抗治疗的 RRMS 患者那样经历抗炎 B 细胞的重建 (83)。
总而言之,上述数据表明 ocrelizumab 可能通过减少炎症来减少 PPMS 的疾病进展。这种作用机制代表了用于治疗 RRMS 的治疗范式的延续,其中主要治疗方式涉及通过减少炎症起作用的药物。ocrelizumab 的益处但多种其他 RRMS 抗炎药的失败,以及 PPMS 与 RRMS 相比的表型差异,对疾病发病机制和治疗具有重要意义。临床试验数据表明,可能有一部分 PPMS 患者,通常是更年轻的、新诊断的 MRI 增强病变患者,他们有导致进行性残疾的活动性炎症,他们将受益于高效抗炎药。PPMS 患者亚组的这些定性差异对我们对 PPMS 患者的分类方式有影响。最近对 MS 分类的修订包括活动性疾病和进展存在的新限定词,这代表了将 PPMS 进一步划分为更具临床价值的组的努力 (27)。在患有或不患有活动性疾病、伴有或不伴有进展的患者中,检查抗炎治疗对PPMS 患者的影响的临床试验将阐明 PPMS 亚型内具有进一步临床意义的表型差异。软脑膜炎症,鉴于它在患有活动性疾病的 PPMS 患者亚群中更为普遍,并且可以在 MRI 上可视化 (60, 61),可以作为一种潜在的生物标志物来识别可能从 B 细胞治疗中受益最大的 PPMS 患者。临床数据还表明,对于大多数 PPMS 患者,特别是那些没有活动性疾病证据的老年患者,进一步的抗炎治疗不太可能影响疾病进展。对没有活动性炎症证据的 PPMS 患者进行专门研究,并在没有炎症的情况下改进神经退行性病变的 MS 动物模型,可能有助于阐明导致 PPMS 疾病进展的非炎症性神经退行性过程。
拓宽我们对 PPMS 疾病发病机制的理解并利用这些知识开发新的有效治疗方法代表了 MS 研究的下一个前沿领域。鉴于与 RRMS 和 SPMS 相比,PPMS 的患病率较低,这使得临床试验招募更加困难,这一目标带来了独特的挑战。此外,EAE 小鼠模型是研究最广泛的 MS 动物模型,鉴于缺乏进行性 MS 病理特征,在 PPMS 中的效用值得怀疑 (94)。对进行性疾病的专门临床研究、进行性疾病的扩展和新型动物模型以及治疗模式的转变有望为 PPMS 患者带来未来的突破。