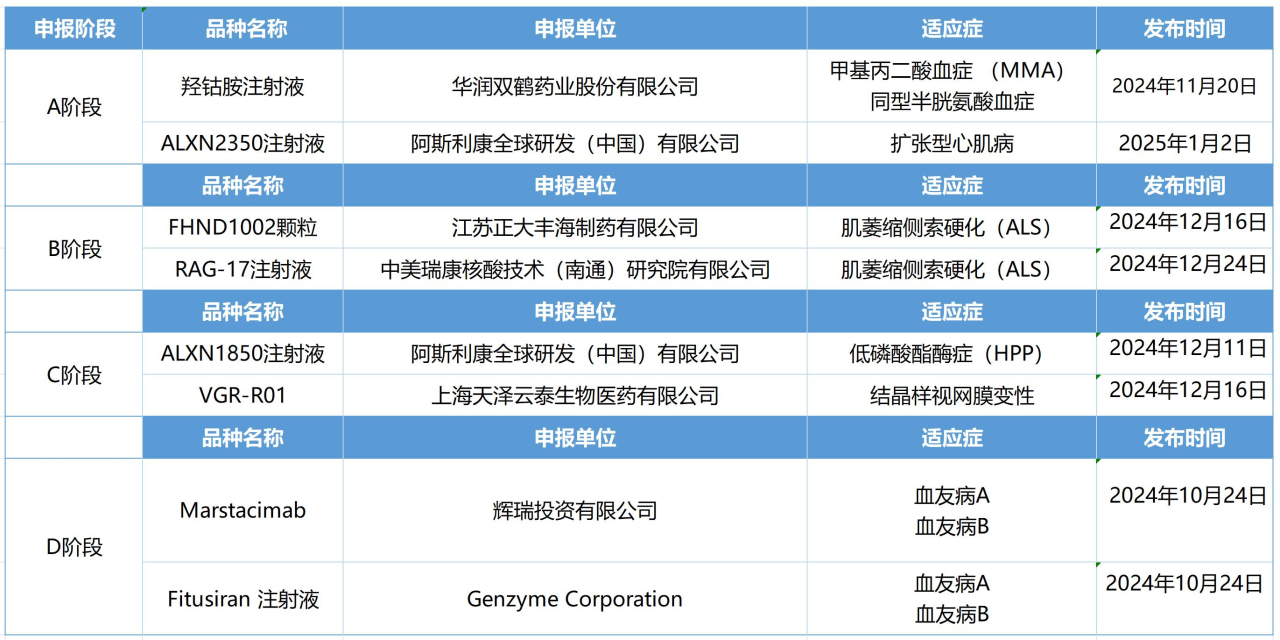
药审中心在A、B、C、D、E各阶段选择1—2个具有代表性的品种纳入“关爱计划”。目前,药审中心在各个阶段共纳入了8个药物,涉及7种疾病,由8家企业研发。
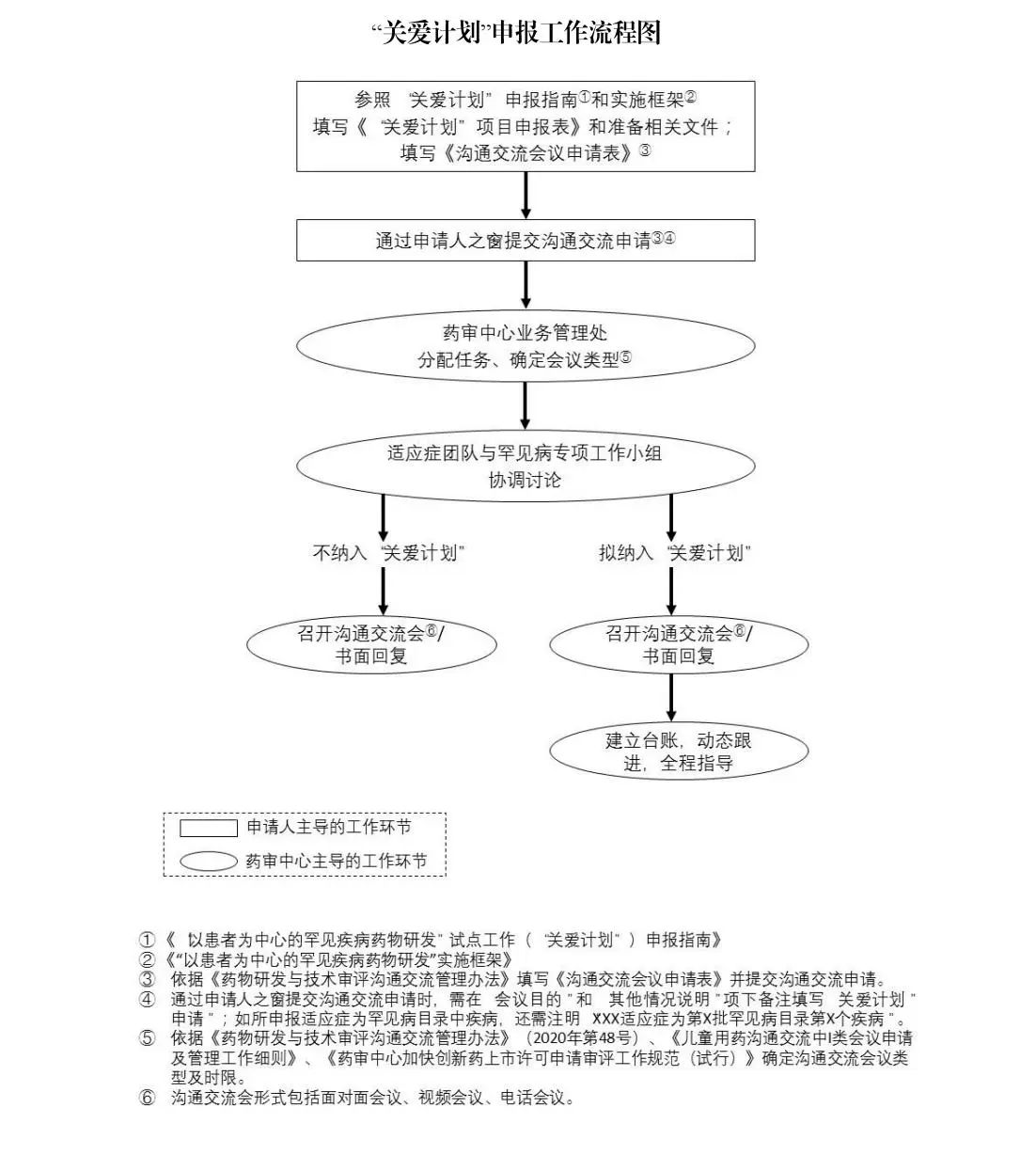
“关爱计划”旨在指导申请人在药物研发的全程,引入罕见疾病患者的观点,提升将与药物临床获益-风险评价相关的患者体验整合入罕见疾病药物临床研发中的科学性、规范性及合理性,并在此过程中增强监管机构、药物研发单位、患者等专注于罕见疾病药物研发的各方沟通与协作,最终促进罕见疾病药物的上市,满足临床需求。
当前,“以患者为中心”的药物研发理念逐步被广泛接受。对于罕见疾病药物而言,在研发过程中,落实“以患者为中心”的药物研发理念,关注患者视角,倾听患者声音,将有助于药物研发企业、研究者、监管机构了解罕见疾病,了解患者需求,从而助力于对此类药物研发的科学流程及技术要求的优化。