近日,CDE官网消息,成都倍特药业股份有限公司联合申请药品“BPR-30221616注射液”,获得临床试验默示许可,受理号CXHL2401051。
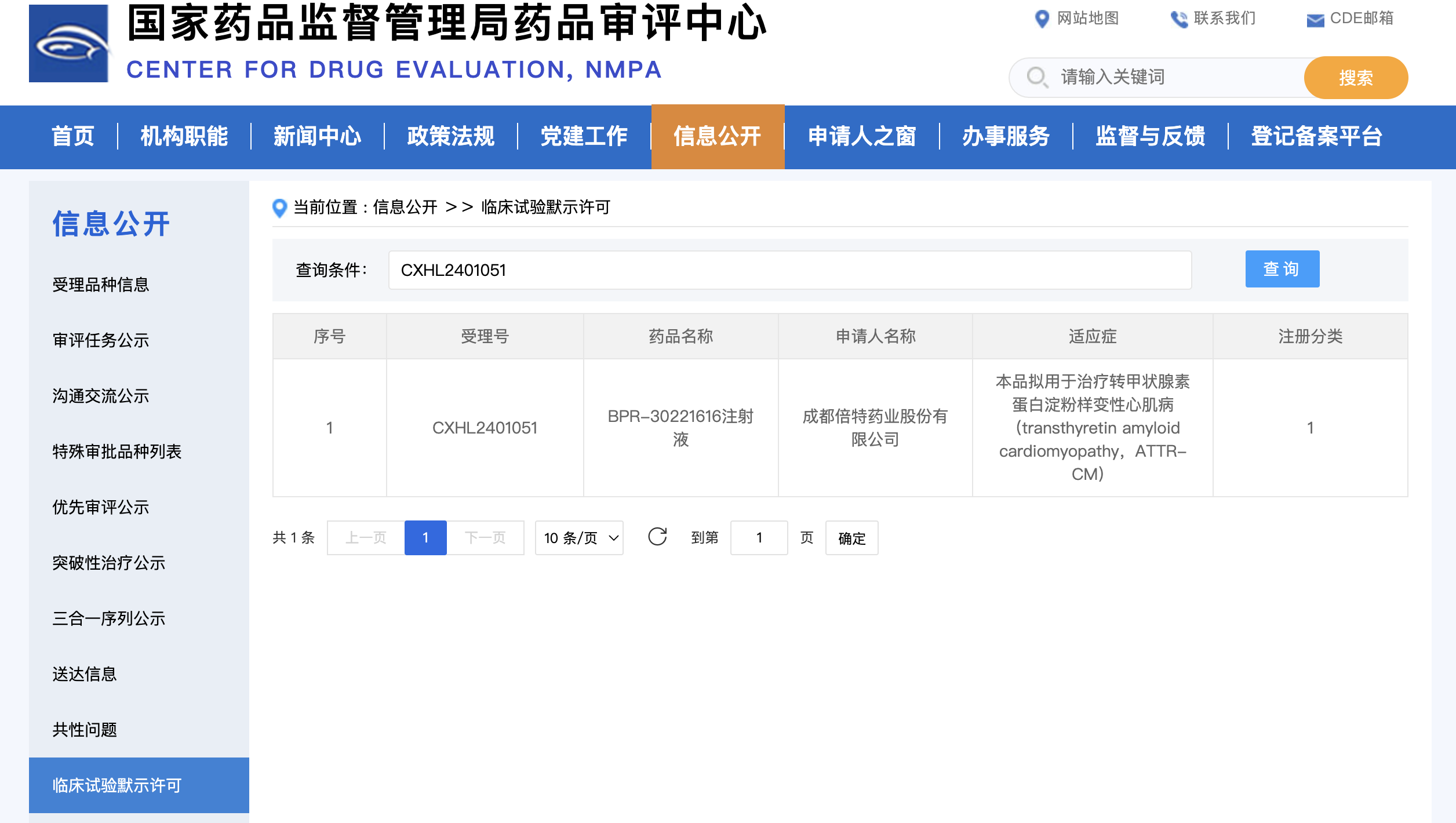
公示信息显示,药品“BPR-30221616注射液”适应症:本品拟用于治疗转甲状腺素蛋白淀粉样变性心肌病(transthyretin amyloid cardiomyopathy,ATTR-CM)。
根据倍特药业新闻稿,BPR-30221616注射液为企业自主研发的1类新药,针对转甲状腺素蛋白(ATTR)靶点的siRNA药物,具有成为同类最佳(Best-in-Class, BIC)的巨大潜力。
据了解,ATTR是国内外新药开发的热点赛道,它不仅是首个上市的RNAi疗法的治疗对象,也是全球首个体内CRISPR基因编辑技术应用的治疗案例。
目前,针对ATTR新的治疗方法的开发主要集中在小干扰RNA(siRNA)、反义寡核苷酸(ASO)、CRISPR/Cas9基因编辑、淀粉样蛋白耗竭剂,国内外已有15+在研或上市产品。
siRNA药物通过靶向并沉默TTR的mRNA,抑制野生型和突变TTR蛋白的表达,有助于清除外周组织中TTR蛋白沉积并恢复这些组织的功能。其代表药物主要包括Patisiran和Vutrisiran。其中Patisiran是全球首款获得FDA批准的RNAi疗法,其主要用于治疗ATTR-PN,但值得注意的是FDA尚未批准Patisiran用于治疗ATTR-CM。而Vutrisiran在HELIOS-B研究中显示出降低全因死亡风险和改善患者生活质量的潜力。
目前,国内临床上主流的用于ATTR疾病治疗药物包括氯苯唑酸软胶囊、氯苯唑酸葡胺软胶囊、二氟尼柳。同时,还有反义寡核苷酸药物Eplontersen(IONIS-TTR-LRx,商品名:Wainua)于今年9月在华申报上市;基因疗法YOLT-201和ART001已经获临床试验审批(IND)。