阵发性睡眠性血红蛋白尿症(PNH)是一种后天获得性造血干细胞克隆性疾病,经典型PNH以溶血、血栓和并发症为主要表现,其发生与补体活化密切相关1,2。值得注意的是,持续溶血是多种临床症状的根源,如果不加以有效控制,可能导致血栓、肾功能损伤、肺动脉高压等多器官损伤,带来严重的疾病负担,甚至危及生命。因此,如何有效控制溶血并减少相关并发症的发生,成为临床研究的一大挑战。基于此,本期内容特邀广西医科大学附属第一医院刘容容教授深入剖析血栓、肾功能损伤以及肺动脉高压的发生机制,并探讨新型的全面控溶治疗策略,以帮助患者改善相关症状。
PNH溶血是引发血栓形成的根本原因
血栓是PNH患者常见且严重的并发症,29%~44%的PNH患者至少发生过1次血栓事件,且血栓事件占PNH患者已知死亡原因的40%~67%,被视为预后不良的独立危险因素3。PNH溶血是血栓形成的根源所在。首先,PNH患者的慢性溶血状态导致红细胞持续裂解,并释放大量游离血红蛋白(一氧化氮[NO]消耗剂)和红细胞精氨酸酶(降解NO合成底物精氨酸),导致NO过度消耗4。NO耗竭会活化血小板,增加可溶性P-选择素的表达,而P-选择素又进一步激活补体系统,形成恶性循环,导致溶血加重。
此外,NO耗竭还会增加纤维蛋白分解产物及凝血抗凝血复合物的含量,促进纤维蛋白沉积和血栓形成5。其次,补体激活导致内皮细胞和血小板表面形成膜攻击复合物(MAC)。前者在受损时表达组织因子,进而激活凝血级联反应。同时,被MAC攻击的血小板表面的磷脂酰丝氨酸暴露,导致因子V聚集,随后产生凝血酶。此外,补体激活还可产生C5a,进而上调纤溶酶原激活物抑制剂-1(PAI-1)的表达,PAI-1水平升高可导致纤溶活性降低。最后,纤维蛋白溶解系统的正常功能需要糖基磷脂酰肌醇锚定蛋白(GPI-AP),而PNH患者缺乏这些蛋白4。上述因素共同作用,加剧了血栓形成。

图1 PNH血栓形成机制
PNH溶血是引起肾功能损伤的根本原因
肾功能损伤是PNH患者除血栓事件外的又一大并发症。PNH急、慢性溶血可通过多种机制介导肾功能损伤,可表现为急性肾损伤(AKI)、慢性肾脏病(CKD),甚至出现肾功能衰竭。约14%~65%的PNH患者存在不同程度的肾功能不全,而肾功能不全可使PNH患者的死亡风险增高8倍6。
AKI通常与溶血发作的加重相关。随着溶血加剧,血浆中释放的游离血红蛋白增多,随后被肾小球过滤。过滤后的血红蛋白通过产生活性氧(ROS)介导对肾小管,尤其是近曲小管(PCT)的直接毒性损伤。同时,血红蛋白在远曲小管(DCT)的酸性环境下转化为高铁血红蛋白。高铁血红蛋白在DCT中沉淀,导致尿潴留、近曲小管中血红蛋白重吸收以及活性氧介导的损伤。此外,在大量溶血的情况下,缺血特征也会加重肾小管的损伤。这些机制均可能导致急性肾小管坏死,从而引发AKI4。
另一方面,PNH的慢性血管内溶血(IVH)可使肾小管上皮细胞反复暴露于血红蛋白中,引起肾小管,尤其是近曲小管含铁血黄素沉积,含铁血黄素可能导致间质纤维化,在CKD的发展中发挥重要作用4,6。此外,PNH复发性微血管血栓形成也可导致肾皮质缺血性坏死和髓质微梗死,介导肾小管萎缩和间质纤维化,导致肾功能受损6。
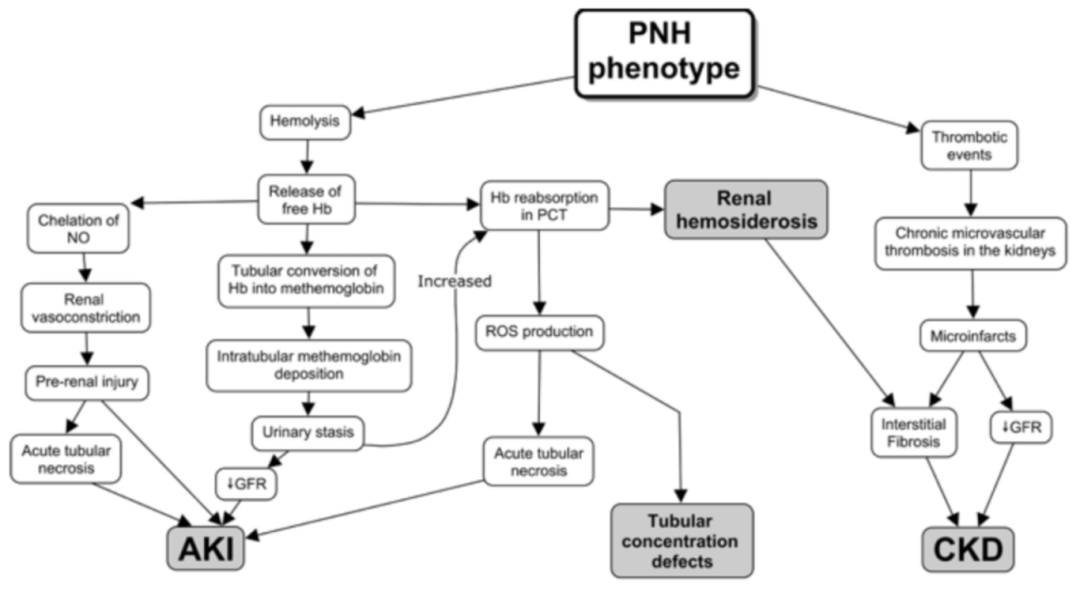
图2 PNH肾功能损伤发生机制
PNH溶血是引发肺动脉高压的根本原因
50%的PNH患者会出现肺动脉高压相关症状,其特征是肺动脉循环内压力升高1。血浆游离血红蛋白对血管内皮细胞具有促炎、增殖和促氧化作用。然而,当PNH患者发生溶血时,释放的大量游离血红蛋白会导致NO的消耗增加。同时,溶血或炎症会损伤血管内皮细胞,从而导致内皮细胞合成的NO也随之减少。此外,溶血还会释放精氨酸酶,导致合成NO的前体L-精氨酸的分解增加,进一步减少NO合成。这些因素共同导致NO的耗竭和生物利用度的下降。在机体内,NO具有重要的生理作用,如调节平滑肌功能、平衡血管的舒缩活动、维持器官血流量等7。因此,NO的耗竭会降低鸟苷酸环化酶的活性,使环磷酸鸟苷水平下降,进而破坏平滑肌细胞的调节功能,增加肺血管阻力,最后促使肺动脉高压形成8。
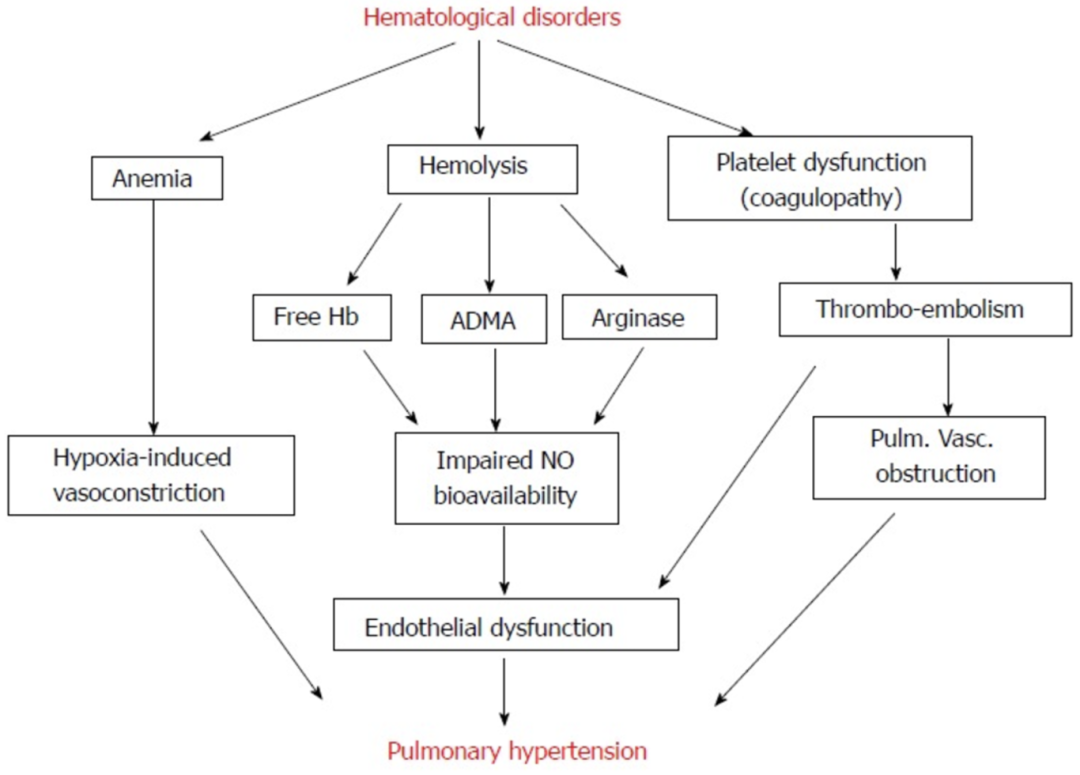
图3 肺动脉高压发生机制
伊普可泮全面强效控制血管内外溶血,遏制PNH并发症根源
溶血是PNH患者发生一系列并发症的根本原因,可导致多器官功能受损,危及患者生命。因此,全面强效控制血管内外溶血对PNH治疗至关重要。正因如此,《阵发性睡眠性血红蛋白尿症诊断与治疗中国指南(2024年版)》1推荐尽早使用补体抑制剂预防和治疗血栓、肾损伤等在内的PNH并发症,其中,伊普可泮选择性抑制补体旁路途径,阻断扩增环放大补体,从而全面强效控制血管外溶血(EVH)和IVH,解决溶血残留问题,成为PNH治疗的新标准。
研究结果显示9,伊普可泮治疗24周时,患者总体PNH(II型和III型)红细胞比例增加至87.1%并持续维持,提示伊普可泮可保护PNH红细胞免受补体攻击裂解,有效控制IVH。此外,C3d+II型和III型PNH红细胞的比例则降至1%以下并保持低水平,提示伊普可泮阻止PNH红细胞表面的C3沉积,有效避免EVH发生。
PNH溶血标志物的变化进一步证实了伊普可泮可全面强效控制PNH溶血。伊普可泮治疗1周时,患者的绝对网织红细胞(ARC)计数迅速恢复正常水平;治疗2周时,患者的乳酸脱氢酶(LDH)水平恢复正常。48周时,LDH和ARC仍维持在正常水平,提示伊普可泮快速、强效、持久控制PNH溶血10,从而有效预防和治疗溶血带来的临床症状及并发症问题。
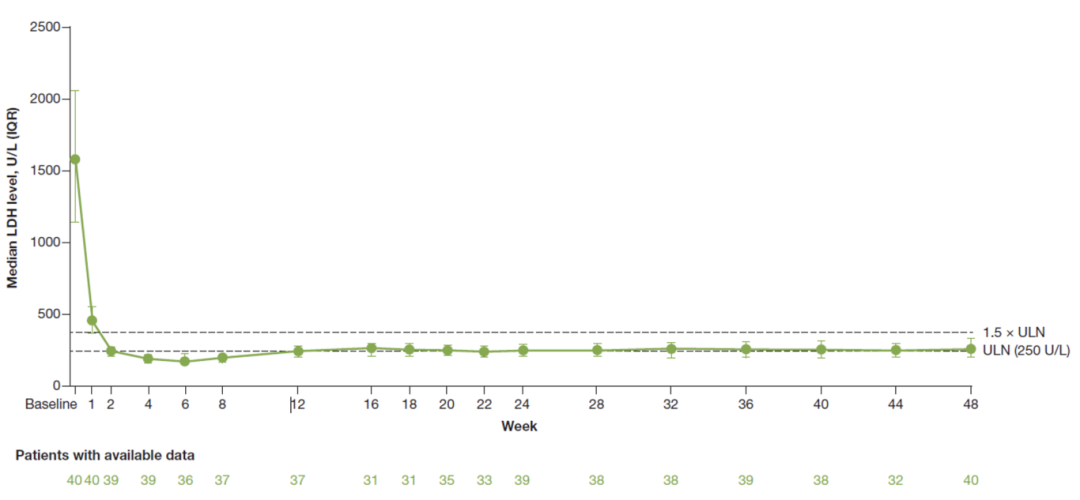
图4 伊普可泮治疗48周LDH水平变化

图5 伊普可泮治疗48周ARC水平变化
总结
近年来,随着研究的逐渐深入,临床对PNH有了更全面的认知。PNH持续性溶血被认为是导致血栓、肾功能损伤等严重并发症的主要原因。因此,在临床治疗中,全面强效控制血管内外溶血成为PNH治疗的根本策略。伊普可泮靶向B因子,选择性作用于补体旁路途径,阻断扩增环放大效应,全面强效控制血管内和血管外溶血,改善由溶血引发的一系列并发症,成为PNH治疗的新选择,并被《阵发性睡眠性血红蛋白尿症诊断与治疗中国指南(2024年版)》推荐为PNH一线治疗用药1,引领患者迈向更高治疗目标!