12月3日,Keros Therapeutics(NASDAQ:KROS),宣布与武田签订独家全球开发和商业许可协议,以推进Elritecept(KER-050)。
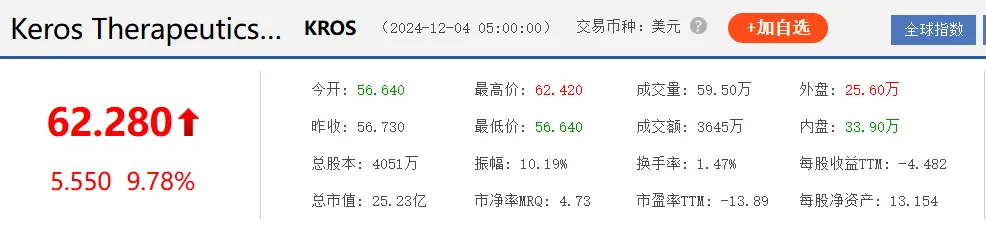
根据协议条款,武田将获得在中国大陆、香港和澳门以外的全球范围内进一步开发、制造和商业化elritecept的独家许可。武田将负责自协议生效之日起的所有开发、制造和商业化。根据协议条款,Keros将获得2亿美元的预付现金,并有资格获得开发、批准和商业里程碑,潜在价值超过11亿美元。Keros还将有资格获得净销售额的分层版税。受此消息影响,Keros Therapeutics股票大涨。
Elritercept目前正在进行两项2期临床试验;一种用于极低、低或中等风险骨髓增生异常综合征(“MDS”)患者,一种用于骨髓纤维化(“MF”)患者。这两种疾病都已被纳入我国罕见病目录。评估Elritercept在患有极低、低或中等风险MDS的输血依赖性贫血成年患者中的3期RENEW临床试验即将开始招募。
Elritercept是一种工程化的配体捕获蛋白,由经改造的IIA型激活素受体(ActRIIA)的配体结合域与人类抗体的Fc区域融合而成。激活素A属于TGF-β超家族成员,它的信号传导增强与骨质流失和骨髓受损有关,导致血液疾病中的病理现象。Elritercept旨在结合并抑制激活素A,有望通过作用于多种细胞谱系来改善骨髓功能并恢复正常造血。Elritercept正在开发用于治疗低血细胞计数,包括MDS和MF患者的贫血和血小板减少症。
Keros Therapeutics创立于2015年,2019年1月完成2300万美元的B轮融资,2020年登陆纳斯达克。2021年12月13日,翰森制药与Keros Therapeutics达成合作协议,翰森制药获得KER-050在中国大陆、香港和澳门地区的开发、生产和商业化独家权益。Keros将收到2,000万美元的预付款,并有望获得高达1.705亿美元的开发和商业里程碑付款,以及产品净销售额的分级特许权使用费。2023年7月,该疗法在中国获批临床。