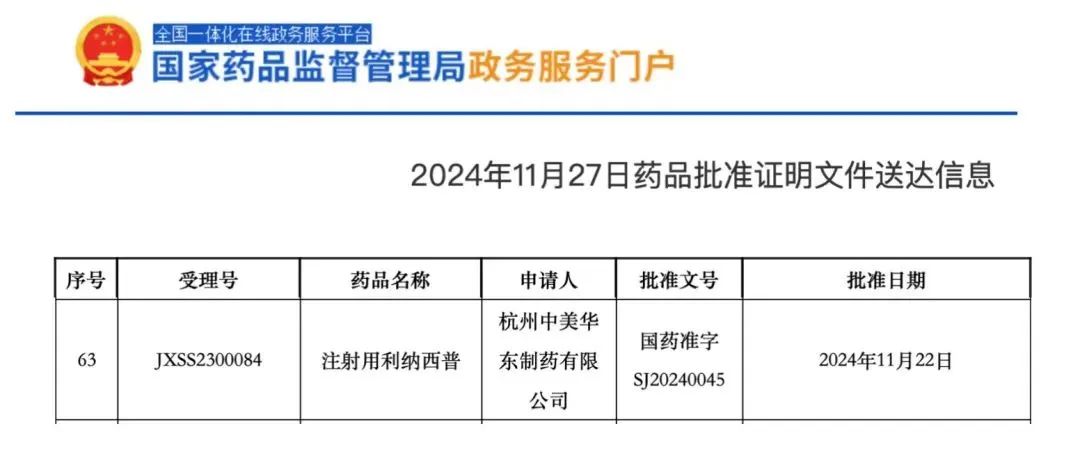
2024年11月27日,中国国家药监局(NMPA)官网最新公示,华东医药IL-1拮抗剂注射用利纳西普(商品名:炎朵)已正式获批。根据中国国家药监局药品审评中心(CDE)优先审评公示,该产品本次获批用于治疗成人和12岁及以上青少年冷吡啉相关周期性综合征(CAPS),包括家族性寒冷性自身炎症综合征(FCAS)、Muckle-Wells综合征(MWS)。
该药的另一项适应症也在今年 3 月申报上市获 CDE 受理(JXSS2400016),用于复发性心包炎(RP),预计有望于 2025 第一季度获批。
冷吡啉相关的周期性综合征(CAPS)早前已在 2018 年度被纳入 CDE 发布的《临床急需境外新药名单(第一批)》中,而复发性心包炎(RP)在 2023 年 9 月被纳入家卫健委等部门联合发布的《第二批罕见病目录》中。
利纳西普早在 2008 年就获得美国 FDA 批准上市,商品名为 ARCALYST®,用于治疗冷吡啉相关的周期性综合征(CAPS),包括家族性寒冷型自身炎症综合征(FCAS)和穆-韦二氏综合征(MWS);2020 年 FDA 又批准拓展其适应症范围,用于治疗 IL-1 受体拮抗剂缺乏症(DIRA);2021 年 3 月又获批用于复发性心包炎(PR)。
冷吡啉相关周期性综合征(Cryopyrin Associated Periodic Syndromes, CAPS)是一种罕见的自身炎症性疾病,由编码 Cryopyrin 的基因 NLRP3 功能获得性突变引起。这种疾病可以导致反复发作的多系统炎症,主要涉及皮肤、肌肉、骨骼、关节、眼、耳以及中枢神经系统,甚至随疾病进展可能出现进行性感音神经性耳聋,为患者带来严重的负担。
注射用利纳西普是一款每周进行皮下注射给药的重组二聚体融合蛋白,可阻断白细胞介素-1α(IL-1α)和IL-1β的信号传导。该产品最早由再生元(Regeneron)研发,并于2008年获得美国FDA批准,用于治疗CAPS。2017年,Kiniksa公司从再生元获得了注射用利纳西普的许可。2022年,华东医药与Kiniksa公司达成一项总额最高达6.62亿美元的合作,获得两款调节免疫信号通路治疗自身免疫疾病药物的相关权益,包括这款注射用利纳西普。目前,华东医药拥有注射用利纳西普在中国、韩国、澳大利亚、新西兰、印度等24个亚太国家和地区(不含日本)的独家许可,包括开发、注册及商业化权益。
注射用利纳西普的获批将为患者带来新的治疗选择。