11月13日,Atamyo Therapeutics今天宣布,美国食品和药物管理局(FDA)已批准其ATA-200的研究性新药(IND)申请,以进行1b/2b期临床试验。ATA-200是一种一次性基因疗法,用于治疗γ-糖聚糖相关的2C/R5型肢带型肌营养不良症(LGMD2C/R5)。
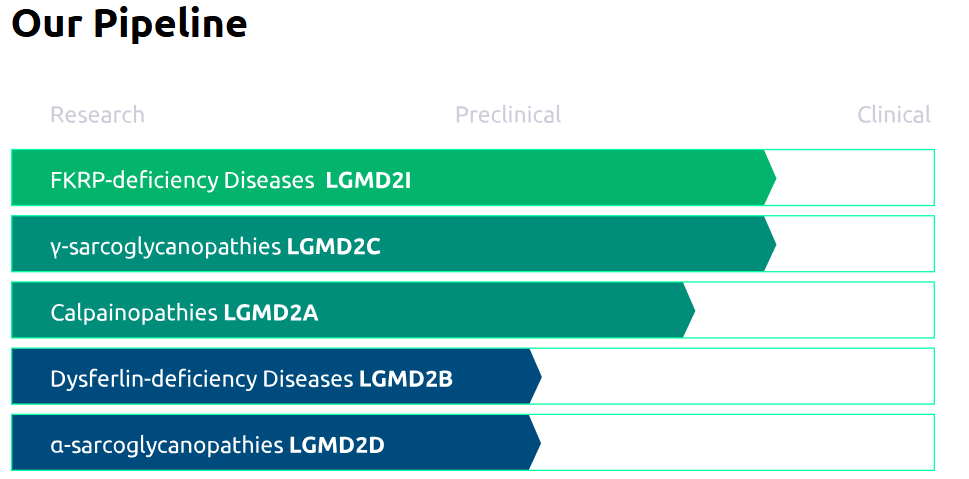
该公司产品管线
肢带型肌营养不良(limb-girdle muscular dystrophies,LGMD)是由Walton和Nattrass于1954年提出的一组以肢带肌无力为主要临床表现的肌肉疾病,用以区别Duchenne型、面肩肱型等已知的肌营养不良症。LGMD有共同的临床特点:多在青少年至成年起病,以肩胛带和骨盆带肌不同程度的无力、萎缩为主要表现,伴血清肌酸激酶(creatine kinase)正常至显著升高。但肢带综合征的临床表现并非这一组疾病所特有,其他肌肉疾病亦可有类似表现。本组疾病在遗传方式、起病年龄、病情进展等方面存在很大的异质性,但限于当时诊断手段有效,在提出该病后的40年内对于此病的研究并无很大进展。
LGMD患者初诊时往往表现为四肢近端无力,需进行充分的临床评估、电生理检查、血生化检测及肌肉活体组织检查(活检),才能得出初步诊断,最终确诊依赖于基因检测。
多中心1B期开放标签剂量递增研究(NCT05973630)将评估接受静脉注射ATA-200(一种携带人γ-糖聚糖转基因的单剂量腺相关病毒(AAV)载体)的儿童的安全性,药效学,疗效和免疫原性。Atamyo的ATA-200临床试验在美国的部署由迪翁罕见病儿童基金会资助。
此外,Atamyo宣布美国FDA已授予ATA-200孤儿药称号。孤儿药资格认定是FDA为鼓励开发罕见病治疗药物而设立的,如7年市场独占权,可为新药开发提供一系列的激励措施,将有助于加快推进ATA-200在全球的后续临床开发和上市进程。
在临床前小鼠模型中,ATA-200证明了其耐受性和纠正病理症状和生物标志物的能力。Atamyo计划在2024年第四季度开始为这项临床试验招募患者。