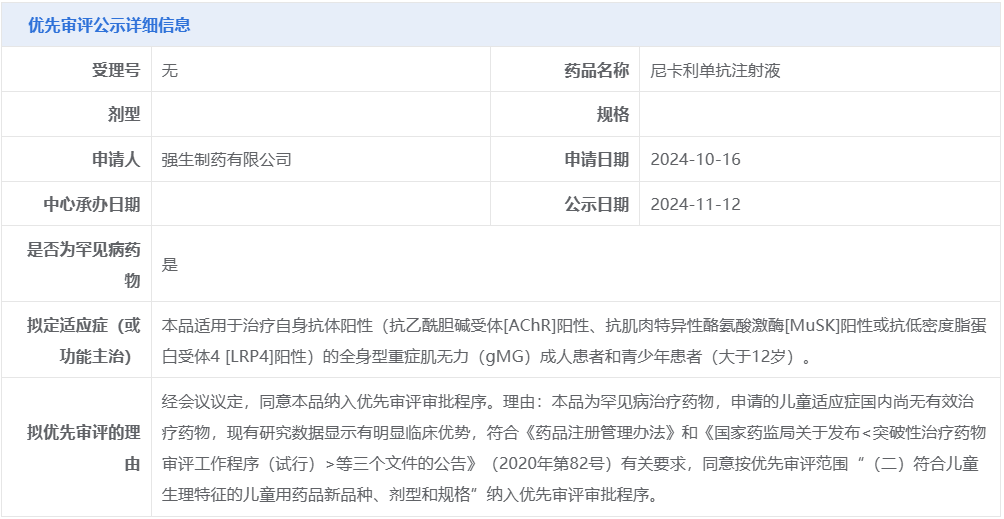
今日,国家药品监督管理局药品审评中心官网公示,强生尼卡利单抗注射液拟被纳入优先审评,适用于治疗自身抗体阳性的全身型重症肌无力(gMG)成人患者和青少年患者(大于 12 岁)。
图源:CDE 官网
尼卡利单抗(Nipocalimab)是强生通过约 65 亿美元收购 Momenta Pharmaceuticals 获得的一款在研 FcRn 抗体。今年 8 月,该药已在美国申报上市,用于重症肌无力。本次被 CDE 纳入拟优先审评意味着该药也有望很快在中国上市。
重症肌无力 (MG) 是一种自身抗体疾病。在 MG 中,免疫系统会错误地攻击神经肌肉接头处的蛋白质,产生抗体(例如抗乙酰胆碱受体 [AChR]、抗肌肉特异性酪氨酸激酶 [MuSK] 或抗低密度脂蛋白相关蛋白 4 [LRP4]),这些抗体会阻碍或破坏正常功能,阻止信号从神经传递到肌肉。
MG 最初的疾病表现通常为眼部,但约 85% 的患者会出现眼肌以外的症状,发展为全身型重症肌无力(gMG)。gMG 已被纳入我国《第一批罕见病目录》。
作为一种 FcRn 抗体,尼卡利单抗旨在以高亲和力结合来阻断 FcRn 并降低循环免疫球蛋白 G (IgG) 抗体水平(包括自身抗体和同种抗体),同时保持免疫功能而不引起广泛的免疫抑制。阻断 IgG 与胎盘中 FcRn 的结合也被认为可以防止母体同种抗体通过胎盘转移到胎儿。
来自3期Vivacity-MG3研究的数据显示,研究参与者包括抗AChR+、抗MuSK+和抗LRP4+b抗体阳性的成年人,这些患者约占gMG患者人群的95%。该研究的主要终点是在24周内测量MG-ADLa评分相对于基线的改善。
分析显示,试验达成主要终点,与基线相较,在第22、23和24周,接受nipocalimab联合标准治疗(SOC)的患者在MG-ADL评分上平均改善了4.70分,显著高于安慰剂联合SOC治疗患者的3.25分(P=0.002)。对于gMG患者来说,MG-ADL评分变化1到2分可能意味着从正常进食到频繁吞咽困难,或从静息时的呼吸急促到需要呼吸机。
此外,该试验还达到了关键的次要终点:在第22周和第24周,定量重症肌无力(QMG)评分测量显示,与安慰剂联合SOC相比,nipocalimab联合SOC在不同肌肉群的力量和功能方面的改善显著更大(P<0.001)。在第22、23和24周,nipocalimab联合SOC在MG-ADL应答(基线改善≥2分)方面显著优于安慰剂联合SOC(P=0.021),这进一步强调了nipocalimab治疗对减轻gMG患者日常生活影响的潜力。
试验中报告的nipocalimab安全性和耐受性与其他试验一致。不良事件、严重不良事件和导致停药的不良事件的总体发生率与安慰剂联合SOC组相似。
强生新闻稿指出,这是首个在 12-17 岁抗体阳性青少年中表现出 24 周的持续疾病控制效果的 FcRn 阻断剂,扩大了尼卡利单抗的研究人群。据悉,在国内,尼卡利单抗正在开展多项研究。