9月29日,中国国家药监局药品审评中心(CDE)官网刚刚公示,阿斯利康(AstraZeneca)以注册分类5.1类申报的eplontersen注射液上市申请已获得受理。公开资料显示,这是阿斯利康和Ionis Pharmaceuticals联合开发的每月一次、可由患者自己皮下注射的反义寡核苷酸(ASO)疗法,该药已经于去年12月获美国FDA批准上市,治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。
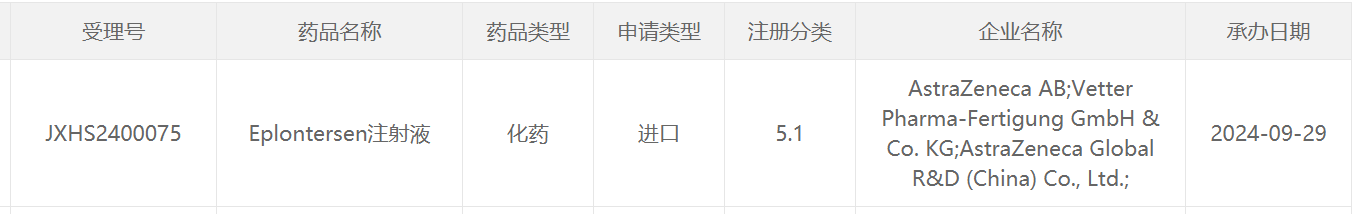
截图来源:CDE官网
ASO药物的单链DNA分子通过与特定RNA序列的结合,可以导致mRNA的降解,或者改变mRNA的剪接,从而达到在mRNA水平靶向疾病潜在机制,治疗疾病的效果。
Eplontersen注射液是采用Ionis公司反义寡核苷酸配体偶联(LICA)技术开发的一款ASO药物。它被设计为一月一次,可由患者自己皮下注射,通过自动注射器自行给药。该产品通过抑制TTR蛋白的生产,从而治疗遗传性与非遗传性的淀粉样变性多发性神经病。

根据Ionis公司公开资料介绍,LICA技术平台通过将不同的小分子偶联在ASO上,可以从多方面改进ASO药物的特征,不但让它们可以通过多种方法给药,而且可以送达到人体的不同器官和组织中。2021年12月,阿斯利康宣布与Ionis公司就eplontersen达成一项全球开发和商业化协议,从而共同开发该产品。
2023年12月,eplontersen获FDA批准上市,用于治疗成人遗传性转甲状腺素蛋白(TTR)介导的淀粉样变性的多发性神经病(ATTRv-PN)。一项在ATTRv-PN成人患者中开展的随机、开放标签、多中心的临床3期试验证明了该产品的疗效。分析显示,在接受治疗35周时,与外部安慰剂对照相比,eplontersen治疗使患者在改良神经病损伤评分+7(mNIS+7)和生活质量指标(Norfolk QoL-DN)总分上出现统计学显著改善。

截图来源:中国药物临床试验登记与信息公示平台
除了治疗ATTRv-PN,研究人员还在开发eplontersen注射液治疗转甲状腺素蛋白淀粉样变心肌病(ATTR-CM)。根据中国药物临床试验登记与信息公示平台官网,阿斯利康已经启动了一项中国国内3期临床研究,旨在中国ATTR-CM受试者中评价eplontersen对转甲状腺素蛋白(TTR)降低的作用和长期安全性。
本次eplontersen在中国申报上市,意味着该产品在中国的进程迎来重要进展。