9月20日,赛诺菲宣布其CD38单抗Sarclisa(艾沙妥昔单抗)的补充生物制品许可申请(sBLA)获FDA批准,用于联合硼替佐米、来那度胺和地塞米松(VRd)治疗不适合接受移植的新诊断多发性骨髓瘤患者(NDMM)。这是Sarclisa在美国获批的第3项适应症。此前,CDE也于今年5月受理了该sBLA。

FDA此次批准主要是基于III期IMROZ研究的积极结果。该研究纳入了446例不适合接受移植的NDMM成人患者,评估的主要终点为无进展生存期(PFS)。
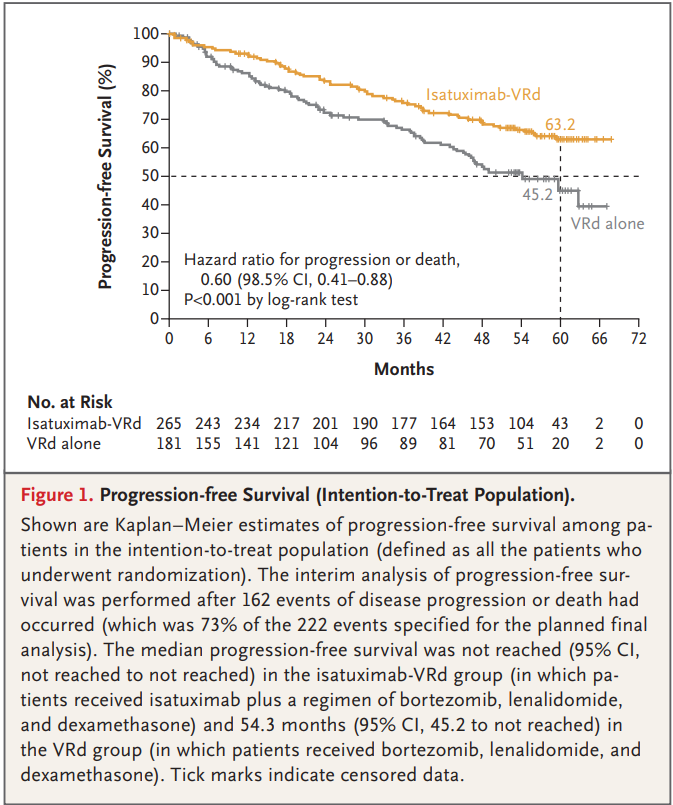
结果显示,中位随访59.7个月时,Sarclisa组患者的PFS显著延长(未达到 vs. 54.3个月);Sarclisa组PFS达到60个月的患者比例显著高于VRd组(63.2% vs. 45.2%),疾病进展或死亡风险降低了40%(HR=0.60,P<0.001)。
Sarclisa是赛诺菲从ImmunoGen(已被艾伯维收购)手中获得的一款CD38单抗,可靶向多发性骨髓瘤细胞上CD38受体的特异性表位,可触发多种不同的作用机制,包括程序性肿瘤细胞死亡(凋亡)和机体免疫反应调节。CD38在多发性骨髓瘤细胞上呈高水平表达,是多发性骨髓瘤和其他恶性肿瘤中抗体治疗的细胞表面受体靶标。
2020年3月,Sarclisa首次获FDA批准上市,用于联合泊马度胺和地塞米松治疗既往至少接受过2线治疗(包括来那度胺和一种蛋白酶体抑制剂)的复发或难治性多发性骨髓瘤成人患者。2021年3月,Sarclisa获FDA批准扩展新适应症,用于联合卡非佐米和地塞米松用于既往接受过1-3线治疗的复发性或难治性多发性骨髓瘤成人患者。