当地时间7月31日,Theriva Biologics(以下简称“Theriva”)宣布,其在研溶瘤腺病毒疗法VCN-01获FDA授予儿科罕见药物资格认定(RPDD),拟用于视网膜母细胞瘤治疗。此前,FDA已授予VCN-01针对视网膜母细胞瘤治疗的孤儿药资格认定。

▲ Theriva官网
视网膜母细胞瘤是一种起源于视网膜胚胎性肿瘤细胞的恶性肿瘤,主要发生在婴幼儿中,是儿童最常见的眼内恶性肿瘤。视网膜母细胞瘤以快速的生长为特征,数周至数月内流体即可充满眼内。若未经治疗,绝大多数患者将在数月内,逐渐丧失他们的视力甚至生命。根据美国癌症协会统计数据,美国视网膜母细胞瘤的发病率为每 100 万人中 3.3 例,每年仅诊断出约 200 至 300 名儿童。该病往往对化疗和放疗不敏感,且复发率高,传统治疗方法如眼球摘除术对患者的生活质量影响极大。
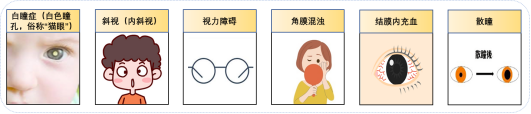
▲视网膜母细胞瘤症状
VCN-01是一种全身给药的溶瘤腺病毒疗法,旨在选择性地在肿瘤细胞内复制并降解肿瘤基质,而肿瘤基质是癌症治疗的重要物理和免疫抑制屏障。这种独特的作用方式使VCN-01能够通过如下方式发挥多种抗肿瘤作用,且全身给药使VCN-01能够对原发性肿瘤和转移性肿瘤发挥作用:选择性感染和裂解肿瘤细胞;增强联合给药化疗药物的进入和灌注;增加肿瘤免疫原性并将肿瘤暴露于患者的免疫系统和联合给药的免疫治疗药物中。
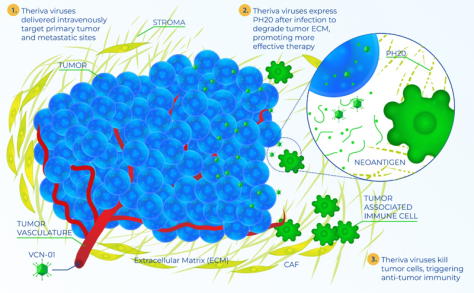
▲VCN-01作用机制
新闻稿指出,VCN-01已在针对不同癌症的1期和研究者发起的临床试验中对超过80名患者进行了给药,其中包括胰腺导管腺癌(联合化疗)、头颈部鳞状细胞癌(联合免疫检查点抑制剂)、卵巢癌(联合CAR-T细胞疗法)、结直肠癌和视网膜母细胞癌(玻璃体腔内注射)等。
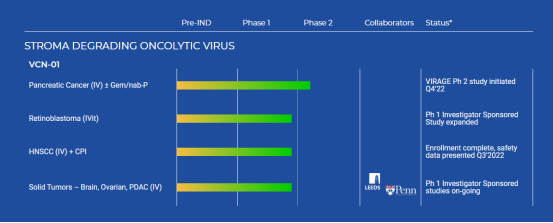
▲官网管线
Theriva首席执行官Steven A. Shallcross表示:“VCN-01被授予儿科罕见病药物资格认定,表明儿科视网膜母细胞瘤患者亟需更好的治疗方案。能获此认定我们很高兴,我们会继续完善将VCN-01用作晚期视网膜母细胞瘤儿童患者化疗辅助治疗手段的临床策略。最近,由研究者发起的评估玻璃体腔内注射VCN-01对难治性视网膜母细胞瘤患者的安全性和有效性的1期临床试验结果也获得了积极的顶线数据。在这一有着极大未满足需求的医疗领域,这项研究的数据无疑是进一步为我们开展临床开发奠定了基础。”