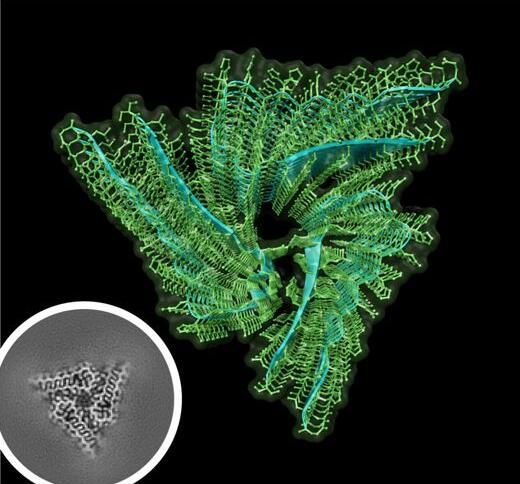
图片来源:Si Lab, Stowers Institute for Medical Research
【1】Science:反常!一种淀粉样蛋白非但不致病,而且还有助于储存记忆
doi:10.1126/science.aba3526
人们已知一种称为胞质聚腺苷酸化元件结合蛋白(CPEB)的mRNA结合蛋白与长期记忆存储相关联。Orb2是CPEB蛋白的果蝇版本。在一项新的研究中,来自美国斯托瓦斯医学研究所、华盛顿大学和堪萨斯大学医学中心的研究人员首次描述了一种内源性的功能性神经元淀粉样蛋白在原子分辨率下的结构。这种淀粉样蛋白由Orb2蛋白自聚集而成。这些研究结果可能产生一些非常有趣的影响,相关研究结果近期发表在Science期刊上。
研究者表示,我们认为当一种蛋白由于某种原因变坏或错误折叠时,淀粉样蛋白通常就会产生,这提示着淀粉样蛋白在一种随机的、不受控制的过程中形成。相反,我们发现淀粉样蛋白可以在特定时间和特定细胞中以特定方式形成。淀粉样蛋白通常是在与它们相关的神经毒性或退行性状态的背景下理解的。就阿尔茨海默病、帕金森病、亨廷顿舞蹈病和克雅氏病(Creutzfeldt-Jakob disease)而言,蛋白以异常方式聚集而形成稳定的不可溶性沉积物,从而对神经系统造成严重破坏。
【2】Science子刊:揭示APOE4加剧α-突触核蛋白病变,而且这种加剧与淀粉样蛋白无关
doi:10.1126/scitranslmed.aay1809
科学家们已经确定了神经退行性疾病的几种遗传风险因素。在这些遗传风险因素中,载脂蛋白E(APOE)ε4等位基因(APOE4)是导致迟发性阿尔茨海默病的最强遗传危险因素,主要是通过驱动淀粉样β病理引起的。最近,人们还发现APOE4是路易体痴呆(Lewy body dementia, LBD)的一种遗传风险因素。APOE4如何驱动路易体痴呆发病风险以及它是否对α-突触核蛋白病理学有直接影响尚不清楚。
在一项新的研究中,来自美国梅奥诊所的研究人员在小鼠模型和帕金森病患者中研究了APOE4是否会影响α-突触核蛋白病理,相关研究结果近期发表在Science Translational Medicine期刊上。在表达APOE2 、APOE3或APOE4的人APOE靶向替换小鼠中使用腺相关病毒(AAV)递送α-突触核蛋白(α-synuclein)基因,培育出突触核蛋白病(synucleinopathy,即α-突触核蛋白异常聚集所参与引起的神经系统变形病)小鼠模型。他们发现在小鼠9个月大时,是APOE4而不是APOE2或APOE3增加了α-突触核蛋白病理、损害了行为表现、加剧神经元和突触损失,并且增加星形胶质细胞聚集(astrogliosis)。
【3】Science子刊:β淀粉样蛋白才是导致阿尔茨海默病的元凶!它劫持去甲肾上腺素信号来激活病理性的GSK3β/tau级联反应
doi:10.1126/scitranslmed.aay6931
在一项新的临床前研究中,来自美国阿拉巴马大学伯明翰分校的研究人员发现了阿尔茨海默病的一个重要缺失部分。这使得利用一种显著降低两种小鼠模型中的阿尔茨海默病病理和症状的现有药物进行概念验证实验成为可能,从而有潜力为这种破坏性疾病提供及时治疗,相关研究结果发表在Science Translational Medicine期刊上。
研究者表示,我们的研究针对β淀粉样蛋白(Aβ)毒性潜在机制提供了临床转化上的新见解,这可能对未来的药物设计产生重大影响。它鉴定出Aβ和G蛋白偶联受体之间的相互作用,这代表着阿尔茨海默病的一种有吸引力的疾病特异性的治疗靶标。有趣的是,这种新发现的发病机制可能也解释了许多阿尔茨海默病临床试验为何遭遇失败,这些临床试验靶向减少这种疾病的罪魁祸首---大脑中的Aβ蛋白堆积。
【4】PNAS:研究揭示β-淀粉样蛋白聚集体结构,揭秘阿尔兹海默症发生发展过程
doi:10.1073/pnas.1818530116
近日,一项刊登在国际杂志PNAS上的研究报告中,来自宾汉顿大学和科罗拉多丹佛大学的研究人员组成的一个研究小组,首次绘制了一种导致阿尔茨海默症加速发展的侵略性蛋白质聚合体的分子结构。研究者表示,大约10%的老年痴呆症病例是由家族突变引起的;另外90%的病例是由野生型淀粉样蛋白折叠不当引起的,我们需要了解疾病病理的分子基础,这样我们或许有一天能创造出防止这种疾病退化的药物。
阿尔茨海默氏症是由一种叫做β-淀粉样蛋白的有毒蛋白质片段形成一种叫做原纤维的链状结构开始发展的,这种结构出现在脑细胞中,并杀死脑细胞。Qiang和科罗拉多丹佛大学的研究人员使用高分辨率的固态核磁共振波谱来研究这些纤维。他们的工作揭示了这些纤维可能在人脑淀粉样沉积的分子结构中具有主要的变异。更重要的是,纤维可以作为进一步纤维沉积的"种子",这是阿尔茨海默病的一个潜在危险因素。
【5】Nature:与阿尔茨海默病相关的β-淀粉样蛋白很可能能够在人际传播
doi:10.1038/s41586-018-0790-y
在一项新的研究中,英国伦敦大学学院朊病毒疾病研究所的John Collinge教授及其团队将一种受到β-淀粉样蛋白(一种与阿尔茨海默病有关的蛋白)污染的生长激素注射到小鼠大脑中,观察到β-淀粉样蛋白在大脑中沉着。这一结果支持这样的一个假设:在罕见的情形下,来自污染的β-淀粉样蛋白可能能够在人际传播,但是这并不意味着这种蛋白具有传染性。
在这项新的研究中,Collinge团队证实当时的一些生长激素受到β-淀粉样蛋白污染。他们随后将受到污染的生长激素注射到经过基因改造后易受β-淀粉样蛋白病变影响的小鼠大脑中。这些小鼠在大脑中产生了β-淀粉样蛋白斑块,然而,这种斑块通常是在阿尔茨海默病患者的大脑中发现的。总之,这些研究结果提示着β-淀粉样蛋白也能够导致这种蛋白的沉着物在人类大脑中产生。
图片来源:CC0 Public Domain
【6】Nature:毒性淀粉样蛋白或有益于机体健康肌肉组织的发育
doi:10.1038/s41586-018-0665-2
近日,一项刊登在国际杂志Nature上的研究报告中,来自科罗拉多大学的科学家们通过研究发现,被认为是多种神经肌肉疾病驱动因素的毒性蛋白—淀粉样蛋白或许在健康肌肉组织的发育上扮演的非常有益的角色。
研究者Thomas Vogler说道,这项研究中我们首次发现,淀粉样蛋白样结构不仅会存在于再生期间的健康骨骼肌中,而且其对于骨骼肌的形成也非常重要。本文研究结果或能帮助阐明一系列难以治愈人类疾病的发病根源,包括肌萎缩性侧索硬化症 (ALS)、包涵体肌病及特定形式的肌营养不良症等。研究者认为,这最终或有望帮助开发治疗肌肉骨骼疾病的新型疗法,同时也能帮助科学家们理解相关神经变性疾病的发病机制,比如帕金森疾病和阿尔兹海默病等。
【7】Neuron:意外!β-淀粉样蛋白通过捕获病毒颗粒阻止疱疹病毒感染大脑
新闻阅读:Amyloid beta protein protects brain from herpes infection by binding to, entrapping viral particles
在一项新的研究中,来自美国麻省综合医院(MGH)的研究人员发现β-淀粉样蛋白(amyloid β-protein, Aβ)---在阿尔茨海默病患者的大脑中堆积而形成斑块的蛋白---保护大脑免受大脑中经常发现的疱疹病毒感染的机制。这一结果支持了疱疹病毒感染在加快Aβ蛋白堆积和阿尔茨海默病进展中发挥的潜在作用。相关研究结果将发表在2018年7月11日的Neuron期刊上。
研究者表示,已有多项流行病学研究提示着遭受疱疹病毒感染的人有更高的风险患上阿尔茨海默病。我们的研究结果揭示出作为大脑中的防御反应,疱疹病毒感染引发大脑中的淀粉样蛋白堆积。通过这种方式,我们将感染假说和淀粉样蛋白假说合并为阿尔茨海默病的一种'抗菌反应假说(Antimicrobial Response Hypothesis)'。在之前的由Tanzi和Moir领导的研究中,他们已发现证据表明Aβ蛋白---长期以来被认为是无用的“代谢垃圾”---是身体先天免疫系统中的一种抗菌蛋白,能够保护动物模型和体外培养的人脑细胞免受危险的感染。
【8】Science:首次解析出史上分辨率最高的β淀粉样蛋白纤维结构
doi:10.1126/science.aao2825
在一项新的研究中,来自德国和荷兰的研究人员利用冷冻电镜技术、固态核磁共振光谱技术和X射线衍射技术,解析出有史以来分辨率最高的β淀粉样蛋白纤维(amyloid-beta fibril, Aβ蛋白纤维)结构。人体自身的Aβ蛋白纤维是与阿尔茨海默病相关联的大脑蛋白沉积物的主要组分。他们解析出的这种原子水平的三维结构揭示出这些有害堆积物生长的之前未知的方面和遗传风险因素的影响,相关研究结果发表在Science期刊上。
这种结构揭示出很多个β淀粉样蛋白(Aβ)分子如何成层地交错排列在一起,形成所谓的原纤维(protofilament)。两个这样的原纤维彼此缠绕在一起,形成Aβ蛋白纤维。如果几个这样的Aβ蛋白纤维缠结在一起,它们就产生在阿尔茨海默病患者的大脑组织中检测到的特征性堆积物或者说斑块。
【9】Science:利用定制的淀粉样蛋白捕获肿瘤
doi:10.1126/science.aah4949
在研究十年之后,比利时开光实验室(Belgian Switch Laboratory, VIB/KU Leuven)揭示出一种新的定制分子通过淀粉样蛋白形成机制,抑制一种经良好验证过的癌症促进物。这项研究证实淀粉样蛋白结构能够被用来合理地开发一种新类型的能够抵抗一系列疾病的生物技术分子。下一步就是将这种突破性技术(被称作Pept-in)转化为给病人带来的直接益处,相关研究结果发表在Science期刊上。
煮熟鸡蛋、啤酒泡沫和蜘蛛丝中的蛋白都拥有一种相类似的结构组分:淀粉样蛋白。这些结构在人体中是有活性的,在黑色素产生和细胞激素储存等过程中发挥着作用。然而,淀粉样蛋白也与白内障、阿尔茨海默病和血凝固障碍等疾病相关联。如今,在Frederic Rousseau教授和Joost Schymkowitz教授的领导下,研究人员发明出一种设计原则,这种原则可能被用来破坏几乎任何一种基于淀粉样蛋白性质的蛋白的功能。
【10】Ang Chem Int Ed:淀粉样蛋白的结构多样性或指示神经变性疾病新疗法
doi:10.1002/anie.201511524
淀粉样蛋白的形成是诸如阿尔兹海默氏症等神经变性疾病的重要特性,近日刊登于国际杂志Angewandte Chemie International Edition上的一项研究论文中,来自德国和美国的科学家通过研究发现,在真正的病人和动物组织中,这些原纤维结构可以采用多种不同的三维架构来呈现。
如果蛋白发生错误折叠,其通常就会被细胞中特殊的蛋白水解酶类降解为无害的组分,然而在特殊的疾病状态下,这些蛋白或多肽链就会形成以稳定原纤维形式呈现的聚集物,研究者们就在阿尔兹海默氏症患者大脑中发现了这种特殊的淀粉样蛋白聚集物形式;这些原纤维具有不同的形态(长度和宽度可变),然而这仅仅是在实验室培养的组织样本中所发现的结果,那么在真正的患者组织中是否也是这样呢?研究人员就对患者和动物机体中不同的淀粉样变性形式的提取物进行研究,相关结果或对于开发新型疗法具有明显的指示意义。