2019年7月1日美国Fulcrum公司Losmapimod药物在FSHD患者中的疗效和安全性第二期临床试验在美国国立医学图书馆临床试验注册中心(ClinicalTrials.gov)正式上线,登记编号为:NCT04003974
我们在近期介绍过Fulcrum公司和GSK公司合作的Losmapimod药物用于抑制FSHD疾病的DUX4的研究并准备临床试验的消息,详见本公众号文章:重磅消息 | Fulcrum公司计划于2019年中旬进行2b期FSHD药物临床试验
下面会具体介绍Losmapimod药物第二期临床试验的细节信息
简要总结:
这是一项评估Losmapimod药物治疗面肩肱型肌营养不良症(FSHD)患者超过24周的安全性和有效性的研究。
详细说明:
本研究是第二期临床试验,随机,双盲,安慰剂对照,平行组,多中心研究,旨在评估losmapimod治疗面肩肱型肌营养不良症(FSHD)患者24周的疗效和安全性。患者将参与该研究约29周。这将包括4周的筛选期,24周的安慰剂对照治疗期和7天的安全性随访期。患者必须确诊为FSHD1并且必须在检测MRI和肌肉活检之前通过FSHD基因检测确认。患者将被随机分配接受15mg losmapimod或安慰剂片剂口服24周。所有患者将被要求参加每个预定就诊的研究中心。
该研究的主要终点是评估losmapimod在抑制或降低DUX4表达方面的功效,如通过FSHD患者的骨骼肌活组织检查中DUX4调节的基因转录物的子集所测量的。次要终点包括评估losmapimod的安全性和耐受性,losmapimod的血浆浓度,骨骼肌中losmapimod的水平以及FSHD患者的血液和骨骼肌中的losmapimod目标参与。
计划参与研究的患者人数:66人
预计研究开始日期:2019年7月
预计主要完成日期:2020年6月
预计研究完成日期:2020年8月
具有基因确诊的FSHD1患者将每天两次口服Losmapimod 15mg,持续24周。
该研究包括24周的治疗期。患者将接受15mg Losmapimod作为两片7.5mg片剂,每天两次口服。研究药物应与食物一起服用,并且每个剂量的日期和时间必须记录。
安慰剂比较:安慰剂
具有基因确诊的FSHD1患者将每天两次口服安慰剂,持续24周。
药物:安慰剂口服片剂
该研究包括24周的治疗期。患者将接受两片安慰剂片剂,每天两次口服。安慰剂片剂与Losmapimod片剂相同。安慰剂应与食物一起服用,每次剂量的日期和时间必须记录。
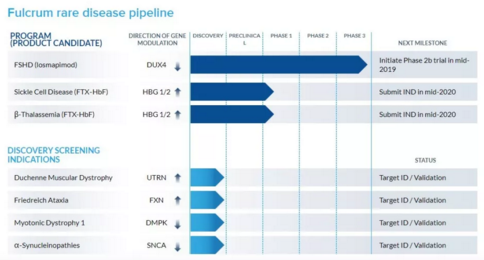
美国Fulcrum公司药物管线,目标:利用我们的专有产品引擎系统地识别和验证可调节基因表达的细胞药物靶标,以治疗遗传定义疾病的已知根本原因。
结果指标
主要成果指标:
DUX4活动[时间范围:第16周]
DUX4活性的基线变化将通过使用DUX4调节的基因转录物的子集的骨骼肌的定量聚合酶链反应(qPCR)来测量。
次要结果指标:
治疗 - 紧急不良事件[时间范围:第25周]
通过临床显着的实验室检查结果,ECG和生命体征评估治疗引起的不良事件的发生率。
Losmapimod的血药浓度[时间范围:第24周]
将收集血样以测量指定时间点的losmapimod的血浆浓度。
骨骼肌中Losmapimod的浓度[时间范围:第16周]
将在两个指定时间点收集肌肉活组织检查以测量骨骼肌中losmapimod的浓度。
目标参与[时限:第16周]
在外周全血和肌肉中测量磷酸-HSP27的基线变化和pHSP27 /总HSP27的比率。
其他成果指标:
肌肉组织量[时间范围:第24周]
通过全身磁共振成像(MRI)测量的骨骼肌瘦肉组织体积从基线的变化。
脂肪替代肌肉组织[时间范围:第24周]
通过全身磁共振成像(MRI)测量的脂肪替代骨骼肌组织从基线的变化。
肌肉疾病成绩单[时限:第24周]
在肌肉活检和血浆和血清中与免疫功能相关的肌肉疾病转录本从基线变化。
可达工作空间(RWS)[时限:第25周]
受试者坐在3D相机前面,并要求在有和没有重量的研究临床评估员的监督下执行标准化的上肢运动协议。
定时站立起来(TUG)。[时限:第25周]
当受试者从坐姿或躺卧位置开始,上升到站立位置,步行总共6米然后返回到坐姿或躺卧位置时,受试者被定时。
肌肉力量[时间范围:第25周]
肌肉力量将通过手持式定量测力计评估。
运动功能测量(MFM) [时间范围:第25周]
其管理神经肌肉疾病的功能测量,其中13项与站立和移动相关。
FSHD健康指数(FSHD-HI)。[时限:第25周]
HI是一个15域名调查问卷,根据患者访谈设计,用于衡量FSHD与健康相关的总体生活质量,包括运动障碍和FSHD的社会和情感影响。将116个问题组合成总分,将分数转换为百分比,其中100表示最大残疾指数,而较低分数表示较少残疾指数。
患者的整体变化(PGIC)。[时限:第25周]
PGIC是一个单一的问题,如果临床状况有改善,下降或没有变化,则按1-7的等级进行评估。
参与该临床试验的资格标准:
年龄:18岁至65岁(成人,老年人)
性别:男性、女性
接受健康志愿者:不接受
入选标准:
患者必须同意参与,并且必须提供符合联邦和机构指南的签署,注明日期和见证的IRB批准的知情同意书。
通过基因诊断4号染色体上D4Z4阵列,确认FSHD1的诊断为1至9次重复。必须在进行检测MRI和肌肉活检之前经过基因检查确认。
临床严重程度评分为2至4(RICCI评分;范围0-5),包括筛查时
必须有符合MRI条件的肌肉进行活检
必须愿意并且能够遵守预定的访问,治疗计划,研究限制,实验室测试,避孕指南和其他研究程序。
将采用经批准的节育方法
排除标准:
有研究者认为可能使研究结果混淆或给受试者施用研究药物带来额外风险的任何疾病或任何临床病症的病史。这可能包括但不限于相关药物或食物过敏史;心血管或中枢神经系统疾病史;除FSHD外的神经肌肉疾病(如肌病,神经病,神经肌肉接头疾病);或有临床定义精神病史。
对于接受可能影响肌肉功能的药物或补充剂的受试者,由治疗医师确定,或包含在方案中提供的药物列表中的受试者,受试者必须服用稳定剂量的该药物(s )或在第一剂研究药物之前补充至少3个月,并在研究期间保持稳定剂量。研究期间剂量或治疗中止的变化只能由治疗医师在严格的医疗原因下进行,并提供明确的文件并通知申办者。
急性或慢性肝病史或已知目前丙氨酸氨基转移酶≥2×正常上限(ULN)或总胆红素> 1.5×ULN,或已知乙肝或丙肝病史。
已知的严重肾功能损害(定义为肾小球滤过率<30 mL / min / 1.73m2)。
乙型肝炎表面抗原(HBsAg),丙型肝炎病毒(HCV)抗体或抗人类免疫缺陷病毒(HIV)-1和-2的抗体的阳性筛选。
男性受试者与女性伴侣计划在研究期间或最后一剂研究药物后90天内有怀孕计划。
在30天或5个半衰期中使用其他研究产品(以较长者为准),或根据当地法规,或目前参与研究产品的研究。注意:如果赞助商以书面形式确认,可以接受同时参与其他非药物研究。
目前该研究在美国10个医学中心和加拿大2个医学中心进行临床试验。
美国10个医学中心分别为:加州大学欧文分校、加州大学洛杉矶分校(UCLA)、佛罗里达大学、堪萨斯大学医学中心、肯尼迪克里格研究所、华盛顿大学医学院、罗彻斯特大学医学中心、犹他大学、弗吉尼亚联邦大学、华盛顿大学医学中心、
加拿大2个医学中心分别为:渥太华研究所、蒙特利尔神经病学研究所和医院

关于FSHD疾病:
患病率
• FSHD在美国的患病人数大约为16,000至38,000人*
• 没有种族或者民族群体限制
• 许多患者最终都依赖轮椅的使用
遗传学
• 66%大约三分之二的病例是遗传的。
• 33%三分之一的病例是散发性的,并非由于该病的家族史。
{*根据最近患病率研究的1 / 20,000和1 / 8,333和美国3.2亿人口的数量}