今日,BioMarin公司宣布,该公司开发的治疗A型血友病的基因疗法valoctocogene roxaparvovec,在3期临床试验中达到预先设定的凝血因子VIII水平临床终点。这一结果支持该公司向美国和欧盟的监管机构递交监管申请。BioMarin计划与美国FDA和欧盟EMA针对这一3期临床数据进行交流,预计在今年第三季度为这一基因疗法递交监管申请。
A型血友病是一种由于遗传原因导致凝血因子VIII缺失的血液疾病。它是最常见的血友病类型,主要影响男性,大约在4000-5000名新生儿中就会出现一例患者。由于凝血因子的缺失导致患者血液不能正常凝结,很多患者会经常出现自发性出血事件。目前,对严重A型血友病患者的标准治疗方法是预防性凝血因子VIII静脉注射。但是即便如此,仍然有很多患者会出现自发性出血事件。严重血友病患者的关节因为时常出现出血事件而导致永久性损伤。
BioMarin公司开发的valoctogogene roxaparvovec是一种使用AAV5载体递送表达凝血因子VIII的转基因的基因疗法。它的优势在于患者可能只需要接受一次治疗,就可以获得表达凝血因子VIII的基因,从而不再需要长期接受预防性凝血因子注射。该疗法已经获得美国FDA授予的突破性疗法认定和欧盟授予的PRIME药品认定。
这项名为GENEr8-1的3期临床试验的中期数据表明,在接受治疗23-26周之后,在16名接受剂量为6e13 vg/kg的valoctogogene roxaparvovec的患者中,使用显色底物(chromogenic substrate)检测,总计8位患者的凝血因子VIII水平达到40 IU/dL。凝血因子VIII水平达到5 IU/dL是划分中度和重度A型血友病的标准。
这16名接受治疗的患者截至到4月30日,平均年出血率(ABR)为1.5,与接受标准预防疗法的患者相比,降低了85%。同时,患者的年度凝血因子VIII用量减少84%,在接受治疗后5-26周之间,患者的年度凝血因子VIII用量减少94%。
“达到这一预先设定的临床终点是一个重要的里程碑。这让我们向美国和欧盟递交监管申请又迈进了一步,”BioMarin公司全球研发总裁Hank Fuchs博士说:“我们与FDA和EMA的交流表明,血友病患者仍然具有高度未竟需求,我们期待继续与监管部门就这一疗法的监管申请进行卓有成效的交流。”
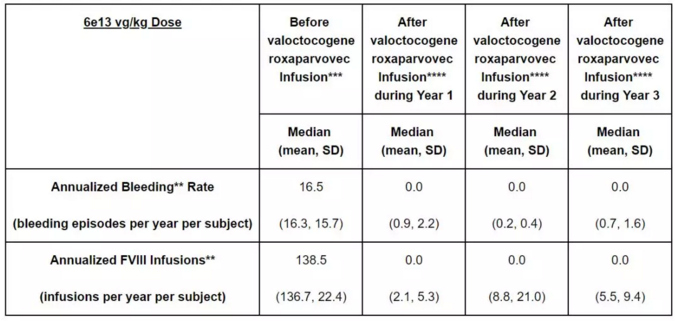
BioMarin同时还发布了这一疗法治疗A型血友病患者的长期随访结果。试验结果表明,在接受剂量为6e13 vg/kg的基因疗法治疗后第三年,患者的平均ABR为0.7,中位ABR为0。同时,患者年度凝血因子VIII用量在第三年与对照组相比减少了96%。这一试验结果显示,valoctogogene roxaparvovec能够为严重A型血友病患者的生活带来长期的改变。
我们预祝这款创新基因疗法能够早日上市,为A型血友病患者造福。
参考资料:
[1] BioMarin Announces that Phase 3 Cohort of Valoctocogene Roxaparvovec, Gene Therapy Study in Severe Hemophilia A Met Pre-Specified Criteria for Regulatory Submissions in the U.S. and Europe. Retrieved May 28, 2019, from https://investors.biomarin.com/2019-05-28-BioMarin-Announces-that-Phase-3-Cohort-of-Valoctocogene-Roxaparvovec-Gene-Therapy-Study-in-Severe-Hemophilia-A-Met-Pre-Specified-Criteria-for-Regulatory-Submissions-in-the-U-S-and-Europe
[2] BioMarin Provides 3 Years of Clinical Data from Ongoing Phase 1/2 Study of Valoctocogene Roxaparvovec Gene Therapy for Severe Hemophilia A. Retrieved May 28, 2019, from https://investors.biomarin.com/2019-05-28-BioMarin-Provides-3-Years-of-Clinical-Data-from-Ongoing-Phase-1-2-Study-of-Valoctocogene-Roxaparvovec-Gene-Therapay-for-Severe-Hemophilia-A