3期STR1VE试验数据显示:延长的无事件生存期、CHOP-INTEND量表评分的早期和快速提高以及1型SMA患者实现重要的里程碑(与START试验一致)
首次人体生物分布数据显示,预期中枢神经靶标的转导和广泛的SMN表达与未受影响的对照组织相当
超过150名接受Zolgensma治疗的患者中,只有5%(最大5岁)在筛选时因AAV9抗体滴度大于1:50被排除在外
诺华旗下AveXis公司2019年4月16日在瑞士巴塞尔宣布,其针对1型SMA患者的Zolgensma®(AVXS-101)3期STR1VE试验的中期数据显示[1],对比未经治疗的患者自然病史,受试患者无事件生存期延长,CHOP-INTEND量表评分的早期和快速增加,以及实现重要里程碑,这些都与关键的1期START试验数据一致。来自STR1VE的首次人体生物分布个案研究数据显示,Zolgensma成功转导了中枢神经系统中的预期靶标,并提供了与未患病个体的组织相当的广泛SMN表达。其他数据显示,在Zolgensma临床试验及管控式用药计划(Managed Access Program)所筛选的患者中,95%都未因AAV9抗体滴度高于1:50而被排除在治疗之外。这些数据于今天在佛罗里达州奥兰多举行的2019年肌萎缩症协会(MDA)临床和科学会议上公布。
AveXis公司首席医疗官,医学博士Olga Santiago说:“来自STR1VE试验的这些数据强化了我们在关键性1期START试验所获得的信息,包括在未治疗患者自然病史中从未见过的延长生存期和实现里程碑的趋势。由于患者人群和基线特征与START试验密切匹配,这些数据进一步加强了支持Zolgensma用于1型SMA的证据。”
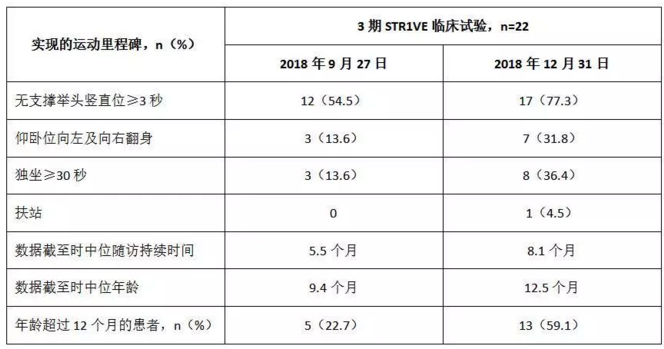
3期STR1VE试验中期数据(截至2018年9月27日)
STR1VE是一项目前正在进行的开放式、单臂、单剂量、多中心临床试验,旨在评估一次性静脉输注Zolgensma对1型SMA患者的有效性和安全性,参试患者接受治疗时年龄都小于6个月。该研究旨在招募尽可能宽泛的1型SMA患者群体,需患者为SMN1基因纯合缺失或点突变,SMN2拷贝数为1或2。这些入组标准与参加关键性1期START试验的患者群体非常匹配,但同时又在探索性的基础上可能为一些更为罕见的亚群提供治疗。STR1VE预计将在2020年完成。
截至2018年9月27日,22名患者中有21名(95%)无事件存活[2]。中位年龄为9.5个月,其中7例当时已达到10.5个月或更大年龄的患者中有6例(86%)处于无事件存活中。未经治疗的患者自然病史表明,50%的1型SMA婴儿在达到10.5个月时无法存活或需要永久性通气[3]。
费城儿童医院神经肌肉病婴儿测试(CHOP-INTEND)量表评分,在基因转移治疗后一个月平均增加7.0分,在治疗后三个月平均增加11.8分,反映了运动功能从基线开始改善。这些数据类似于拟议治疗剂量队列(队列2)在关键性START试验中的CHOP-INTEND得分,该试验表明在相同时间点分别平均增加9.8分和15.4分。早期即获得CHOP-INTEND评分提高似乎与最终实现的里程碑有关。
对于使用Zolgensma治疗的患者的初步评估显示了运动里程碑的实现,其中包括截至2018年9月27日,3名患者可以独坐至少30秒(中位年龄9.4个月),截至2018年12月31日,实现相同里程碑的患者增加至8名(中位年龄12.5个月)。
安全性观察与关键的1期START试验中的观察结果相当。特别关注的不良事件,包括转氨酶升高、血小板数量降低和血小板减少症,是短暂的并且不会引起任何长期后遗症。一名患者死于呼吸衰竭,研究者和独立的数据安全监测委员会认为这与治疗无关。该患者已表现出显着的运动改善,治疗后5个月CHOP-INTEND评分从基线值增加了27分。 AveXis公司对于参与相关试验的勇敢的患者和家庭表示感谢,这使得公司能够进一步努力,为罕见遗传病患者的生活带来有意义的改变。 Zolgensma的生物分布 来自已故患者的组织的首次人体分析显示,Zolgensma成功转导中枢神经系统组织,包括脑和脊髓运动神经元,并显示SMN的广泛表达,与未患病个体的组织相当,且与未治疗的SMA患者组织样本明显不同。 通过ddPCRTM,RT-PCR和免疫组化SMN蛋白染色分别对Zolgensma转基因DNA、mRNA和SMN蛋白生物分布进行了评估。这些分析的结果一致证明了Zolgensma载体基因组、RNA转录物和SMN蛋白在所有测试的器官中广泛分布并被检测到。在颈部、胸部、腰部和骶骨区域检测到每个二倍体基因组的Zolgensma载体基因组。相应地,在每一个这些脊髓区域中,SMN蛋白在脊髓运动神经元中的表达水平与非1型SMA患者的组织相似。此外,在运动皮质和髓质的皮质及皮质下区域中也检测到SMN蛋白的表达。经Zolgensma治疗和非1型SMA患者的组织均明显不同于未治疗的1型SMA患者的组织。 运动神经元标志物胆碱乙酰转移酶(ChAT)的分析表明,在Zolgensma治疗的患者组织中运动神经元丰富,且具有正常的大小和形状。相反,未治疗的1型SMA患者组织中的ChAT运动神经元染色是稀疏的,表明运动神经元不健康和/或在死亡。 这些人类数据支持最初在小鼠和非人类灵长类动物模型的非人类非临床研究中发现的作用机制,单次静脉注射Zolgensma能够恢复缺乏功能性SMN1基因的运动神经元中SMN的表达,从而解决了SMA的根本致病因。 AAV9抗体数据 Zolgensma使用腺相关病毒载体9(AAV9)引入SMN基因的功能性拷贝。AAV9是一种在已知范围内不会引起人类疾病的常见病毒,在幼儿中抗AAV抗体的流行率较低,降低了对AAV9载体免疫反应的可能性[4],[5],[6]。接受Zolgensma筛查的5岁以下患者大约有5%(9/177)被排除在临床试验(包括静脉和鞘内给药)和管控式用药(Managed Access Program)治疗之外,因为AAV9抗体滴度超过了1:50。在接受筛查的患者中,迄今为止已有超过150名患者接受了Zolgensma治疗。 关于Zolgensma® Zolgensma®(AVXS-101)是目前正在开发的一种研究基因疗法,作为1型SMA患者的一次性输注治疗。Zolgensma旨在解决SMA的单基因根本病因,并通过提供一个人类SMN基因拷贝,以快速持续的SMN蛋白表达来阻止疾病进展,避免进一步的肌肉退化。Zolgensma代表了使用基因疗法治疗罕见单基因疾病的专有平台中的第一。2018年12月,FDA接受了公司提交的生物制剂许可申请,将Zolgensma用于1型SMA患者。该药物之前已获得突破性疗法认定,并已获得FDA的优先审评,预计将于2019年5月采取监管行动。此外,该药物预计将于今年晚些时候在日本和欧盟获得批准。 参考文献: [1] The brand name Zolgensma? (onasemnogene abeparvovec-xioi) has been provisionally approved by the FDA for the investigational product AVXS-101, but the product itself has not received marketing authorization or BLA approval from any regulatory authorities. [2] An event is defined as either death or at least 16 hours per day of required ventilation support for breathing for 14 consecutive days in the absence of acute reversible illness or perioperative change. [3] Finkel RS, et al. Neurology. 2014;83:810-817. [4] Colella P, et al. Mol Ther Methods Clin Dev. 2017;8:87-104. [5] Calcedo R, et al. Clin Vaccine Immunol. 2011;18:1586-8. [6] Mimuro J, et al. J Med Virol. 2014;86:1990-7.