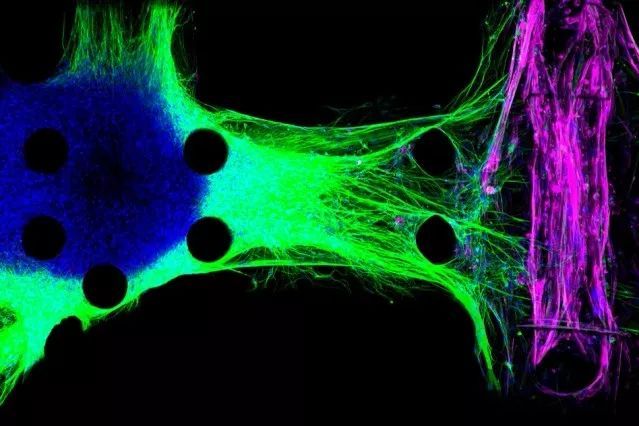
· 3D组织模型重现遭受肌萎缩侧索硬化症影响的运动神经元连接
肌萎缩侧索硬化症(ALS)是一种目前无法治愈的疾病,会导致患者体内支配肌肉的运动神经元数量逐渐减少。美国每年有近6000人被诊断出患有该病。
在最近一项可以帮助科学家开发和测试新药的先进研究中,麻省理工学院(MIT)的工程师们设计出一种微流体芯片,并在上面产生了运动神经元和肌肉纤维接口的首个3D人体组织模型。研究人员使用健康受试者或ALS患者的细胞在该模型中生成神经元,使其能够测试潜在药物的有效性。
该研究资深作者Roger Kamm是MIT机械与生物工程系塞西尔和艾达·格林特聘教授。他说:“我们发现健康细胞和ALS细胞之间存在显著差异,同时还能展示两种正在进行临床试验的药物的效果。”
MIT博士后Tatsuya Osaki是研究论文第一作者。该论文10月10日发表于《科学·进展》(Science Advances)杂志,前MIT研究生Sebastien Uzel也是作者之一。
3D接头
几十年前,科学家就开始建立运动神经元和肌肉细胞之间连接即神经肌肉接头的组织模型。但这些仅限于二维结构,而二维结构并不能完全再现该组织的复杂生理机能。
两年前,Kamm和他的同事们建立了首个神经肌肉接头的3D模型。该模型由分别位于微流体芯片相邻区室的神经元和肌肉纤维组成。一旦神经元被置于区室中,它们就会延伸出名为神经突起的长纤维,最终附着在肌肉上,使得神经元能够控制肌肉运动。
这些神经元经过了改造,以便研究人员可以利用光来控制它们的活性,这种技术被称为光遗传学。研究人员将肌肉纤维缠绕在两根可弯曲的柱状物上,当神经元被光激活时,可通过测量柱状物的位移来测量肌肉纤维收缩的程度。
在2016年版本的模型中,研究人员使用小鼠细胞来培育神经元和肌肉细胞,但物种间的差异可能对药物筛选造成影响。在新的研究中,他们改用人类诱导多能干细胞来生成肌肉细胞和神经元。在证明该系统有效后,他们开始结合生成自散发性ALS患者诱导多能干细胞的神经元。散发性ALS占所有ALS病例的90%。
这种ALS模型表现出了与健康细胞产生的神经肌肉接头的显著差异。Kamm说,神经突起生长较慢,而且似乎无法与肌肉纤维形成牢固的连接。
“如你所见,健康的神经突起可以直接进入单个肌管并继而激活它们。但ALS神经元似乎不能很好地与之连接。”
这意味着对肌肉的控制能力较弱:两周后,受ALS运动神经元支配的肌肉所产生的力量仅为受健康神经元支配的肌肉力量的四分之一左右。这也提示ALS运动神经元会侵害健康的骨骼肌组织。
伊利诺伊大学厄巴纳-尚佩恩分校电气、计算机工程与生物工程教授Rashid Bashir虽然并未参与此项研究,但他发表了评论。他说:“使用来自ALS患者的人源神经细胞,并将其与干细胞衍生的肌肉细胞相结合,从而形成功能性神经肌肉接头,这是芯片上组织模型领域的重大进步。”
潜在药物
研究人员们随后使用他们的模型来测试两种正在进行ALS临床试验的药物:雷帕霉素和伯舒替尼。他们发现同时给予这两种药物可以恢复ALS运动单位中丧失的大部分肌肉力量。该治疗还降低了ALS运动单位中的细胞死亡率。
通过与当地一家生物技术公司合作,Kamm和他的同事们希望能收集到1000名ALS患者的诱导多能干细胞,从而进行更大规模的药物研究。他们还计划扩大该技术规模,以便可以一次性测试更多样本,并增加更多细胞类型,例如在神经系统中发挥支持作用的施万细胞和小胶质细胞等。
该组织模型还可用于研究其他肌肉疾病,比如影响脊髓中神经细胞的脊髓性肌萎缩。
外文:Testing new drugs with “ALS-on-a-chip”