
图片来源于Anthera官网
Anthera制药(Anthera Pharmaceuticals)前不久宣布:Sollpura治疗囊性纤维化所致胰腺外分泌机能不全的3期临床研究RESULT,已经获得欧洲囊性纤维化学会临床试验网络(ECFS CTN)执行委员会批准。ECFS CTN的目标是加强囊性纤维化领域的临床研究,尽可能快地将新药物带给患者。RESULT将按计划在美国和欧盟进行招募,而纳入ECFS CTN可能进一步加快该临床试验的患者招募。预计将在2017年底至2018年初获得顶线数据,具体时间取决于患者招募速度。
“能够获得ECFS执行委员会批准将RESULT试验纳入ECFS CTN,让我们感到非常高兴,”Anthera公司总裁兼首席执行官Craig Thompson说,“这一成就,连同囊性纤维化基金会疗法开发网络的早期批准,代表着RESULT试验的另一个关键里程碑。”
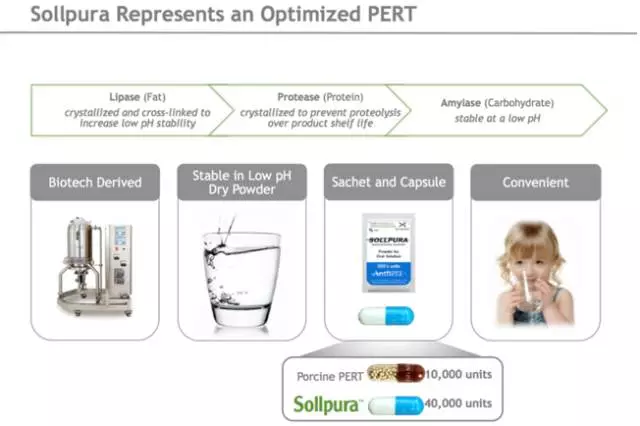
RESULT临床研究设计从之前Sollpura试验(SOLUTION)的数据演变而来,基于临床体征和症状,允许更频繁和更高剂量的调整。和目前的猪酶(porcine enzymes)实践一样,RESULT研究允许在个性化的基础上增加剂量以达到最大的治疗益处,同时由于Sollpura明显更紧致的配方技术,每日的用药负担可能减少。
关于RESULT
3期RESULT研究被设计为评估Sollpura在个性化剂量下治疗囊性纤维化所致胰腺外分泌机能不全,与获批猪源性肠溶衣胰酶替代疗法(PERT)相比的非劣效性。这项研究将招募筛选时被稳定猪PERT疗法控制良好的患者(N≈150),脂肪吸收系数(CFA)可表明这点。主要疗效变量将评估Sollpura或Pancreaze治疗4周后,CFA从基线的改变。随机分配到Sollpura的患者将接受额外20周扩展期(研究共计24周)随访,以便对体重、身高、体重指数和安全性进行更长期的评估。
关于Sollpura®(liprotamase)
图片来源于Anthera官网
Sollpura是一种新型、非猪的PERT,含有一种交叉连接结晶脂肪酶、结晶蛋白酶和非晶态淀粉酶的专有、生物技术衍生配方,具有广泛的底物特异性。该药物以精确和固定比例配方,提供在类似胃部酸性pH环境中的稳定性,没有肠溶衣。作为非猪产品,Sollpura减轻了与猪相关的风险,包括供应限制和猪相关病毒或其他传染性病原体的污染。此外,考虑不存在肠溶衣情况下的稳定性,一种可溶、可饮用的Sollpura配方正在开发中,这可能为儿科患者和通过饲管获得营养的患者提供易于管理的选择。
关于Anthera制药公司
Anthera Pharmaceuticals, Inc.

Anthera制药是一家生物制药公司,专注于开发和商业化产品,以治疗严重和危及生命的疾病,包括胰腺外分泌机能不全和IgA肾病。
原文链接:
http://investor.anthera.com/releasedetail.cfm?ReleaseID=1037171
------------------
原文翻译/曹文东
校审/夏蓓
本文由中国罕见病网编译,转载请注明出处。