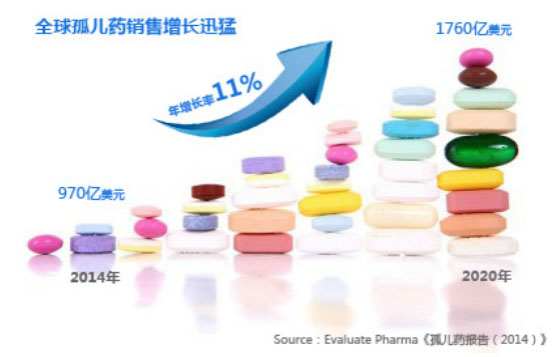
罕见病往往是某种常见疾病机理的集中反映。对罕见病“孤儿药”的研究,获益的绝不单单只是罕见病患者,还包括了你跟我这样的普通人。我们来看看,中国是如何探索“孤儿药”之路的。
仿制之路
相较于自主研发,对中国罕见病药物市场而言,更现实的一条路径是,对那些专利保护已经过期的创新药进行仿制,从而降低药物价格、惠及多数患者。
仿制药与原研药在剂量、安全性、效力、质量、作用以及适应症方面相等同。北京协和医学院特聘教授张宏冰对CSR环球网表示,目前,做好罕见病药物的仿制其实是一个“基础”。
美国的《孤儿药法案》就规定,对于仿制药,不需要重复进行创新药批准之前进行的多年临床前动物研究和人体临床研究,只要证明和创新药的生物等效性即可获得批准,现在美国市场约有50%的药物都是仿制药。
印度更是专注仿制药40余年,基于其国内的“强制许可”政策,印度以其低廉的罕见病药价格被称为“发展中国家的药房”。可见仿制药的地位不可忽视。

图:印度人争取扩大本土厂商仿制药的权利
尽管印度的仿制药之路也走得磕磕绊绊、饱受争议,但其国内药企、病患乃至不少发展中国家的病人都曾受益于此。
1960年,刚成立的印度药企兰伯西瞄准了瑞士罗氏公司的镇定剂苯甲二氮Valium,8年后它通过匈牙利(当时此国不承认专利权)的一家药厂获得了这种镇定剂的原料药,制成制剂后包装,并于1969年冠上Calmpose的牌子出售,第一年就卖了100多万美元,Calmpose也成为印度本土最早的知名药品品牌。自此,这种仿制药物的商业模式在印度蓬勃起来。此前,印度一直沿用英国的产品专利法,本土药企无力研发新药,只能代销海外药品或者少量生产一些专利过期的产品。
为了让仿制行为名正言顺,从上世纪60年代开始印度政府开始不承认西方的药品专利。1970年出台的《专利法》将从英治时代延续下来的“产品专利保护”转变为“工艺专利保护”,对食品、药品等只授予工艺专利,不授予产品专利,也就是说,印度的专利保护只限于制造工艺,并不包括成份。随后,印度政府还先后颁布法令,对药品价格、国外药企在印度的生产和销售做出限制。

图:印度已成为全球价廉物美的大药房
好了,这下子印度药企可以合法地随意仿制任意一种药物。一个通过美国FDA审批的药物,仅3个月后就能在印度市场找到仿制药。在法案颁布后的几十年间,印度仿制药快速增长,制药企业数量也迅速增加,1970年还只有2257家,2005年就超过23000家。 在欧美国家的强烈要求以及WTO的监督下,印度曾在1999年和2002年两次调整专利法;2005年印度政府第一次给予药品以专利保护,但却只限定于1995年以后出现的创新化合物,同时对现有药品的衍生新药能否申请获得专利又提出了近乎严苛的要求。而在如今的生物制药时代,大量的创新研发成果都属于衍生药范畴。而更强悍的是,印度还立法,让政府有权力实施“强制许可”。换言之,如果政府觉得有必要,即使专利拥有者不同意,某个专利也可以被强制性地授予其他人,而后者只需要向专利方支付一定使用费即可。 著名的例子有一种叫格列卫的药物,是治疗白血病的药物,由诺华药厂在1933年成功研发。目前在售的产品比最早的版本分子结构稍有不同,疗效却更加突出。根据印度法律,最新的格列卫是不享受专利保护的衍生药物,任何药厂都可以随意仿制。 图:7年药品专利战争,诺华梦断新德里 2009年诺华公司向印度最高法院申诉,以格列卫属于“疗效升级药”为理由指控印度政府违反了世贸组织的专利规则。结果?自然是诺华的请求被驳回,印度两家本土制药商Cipla和Natco正大量仿制最新的格列卫,并且定价远低于诺华。 如今,印度制药产业的大部分产值都来自于仿制药,低廉的药价让它成为全球主要药物出口国。这种模式不仅受到联合国赞誉,也拿到了不少国际认证。近几年来,印度获批的仿制药申请基本占到FDA批准总量的1/3,目前它已是美国境外拥有最多FDA认证药厂的国家。 仿制之路是否适合中国? 就拿格列卫来说,它的中国专利期到2013年4月已经截止,公开消息显示,国内至少有两家药厂在生产它的仿制药,标价都在4000元左右,虽然低于格列卫24000元左右的进口价(中国是格列卫全球价格最高的市场),但在印度,格列卫仿制药只是要价200多元。去印度买?当然可以省钱,只是你必须面临法律风险。 图:白血病患者陆勇因在印度代购仿制药而被羁押 年初,白血病患者陆勇就因为自己及病友在印度购买格列卫的仿制药而被羁押,理由是“销售假药罪”。 在中国,仿制药也同样需要面对繁琐的药品注册、审批流程;“以药养医”的卫生医疗体制也使药物的定价标准更加复杂。“大家都喜欢贵的药,医院和医生喜欢,因为回报高,患者也倾向于相信贵的药。”张宏冰对CSR环球网坦言:“价格低的仿制药可能就跟国家利益有冲突了,它跟GDP有关……所以很难得到支持和推进。”。 但张宏冰认为,仿制药是一条更适合我们的道路,政策扶持必不可少,比如为它建立有效的审批“绿色通道”——持同样观点的还有华北制药新制剂分厂厂长刘树林,这多少可以代表医学界和药企的观点。去年我国发布的《关于深化药品审评审批改革进一步鼓励药物创新的意见》也规定了“针对仿制药注册申请,属于……罕见病用药等特殊人群用药,以及其他经上市价值评估确认为临床急需的药品,实行优先审评”,各界都在期待这项条款可以发挥实际效力。 老药新用更高效? 无论进口药还是仿制药,目前尚未能解决中国罕见病患者的用药问题。不少医生、专家开始在这两条道路以外寻找更合适的解决方法。例如,将一些非罕见病药物的适用范围拓展至罕见病病征。 国际上已有先例。镇静剂沙利度胺曾因致畸的副作用一度被逐出市场,但随后科学家发现这种药物能够调节免疫系统,1998年美国FDA又重新批准它上市,用于治疗多发性骨髓瘤、麻风结节性红斑等疾病。类似的西地那非,这种原本用来治疗勃起障碍的药物在2005年获批用于治疗罕见病肺动脉高压。 在中国,解放军总医院儿童医学中心主任邹丽萍正申请将免疫抑制剂雷帕霉素的适应症拓展至结节性硬化症。由于基因出现缺陷,这种罕见病患者的多种器官(包括脑部、心脏到肾脏、皮肤等等)会出现多发性的肿瘤问题,患者从婴幼儿期就开始受累于频繁而持续的癫痫,进而影响到患儿的智力发展。 从2011年开始的两年里,邹丽萍收治了156名结节性硬化症患儿,并对其中52人做了24周到96周的随访。她的研究表明,利用雷帕霉素进行治疗,会在很大程度上改善患儿癫痫发作的次数和情况,病人使用的抗癫痫药物种类也可以相应减少。 目前,解放军总医院儿童医学中心正在与华北制药合作,生产一批雷帕霉素药物。在这批药物里,结节性硬化症将被纳入为适应症,相关审批手续正在进行中。刘树林对CSR环球网表示,国家对仿制药审批相对会快一些,成功的几率也比较高。 研究惠及全人类 据调研报告《孤儿药报告(2014)》(来自Evaluate Pharma)预期,从2014年至2020年,全球孤儿药销售规模的年增长率将达到11%,是处方药(仿制药除外)的两倍;市场规模将从2014年的970亿美元增长到2020年的1760亿美元,占处方药(仿制药除外)市场规模的19%。而法国咨询公司Alcimed则表示,治疗罕见病的药物已成为医药行业最盈利的板块之一,几乎所有国际大型制药公司都加大了罕见病药物的研发投入。 国内药企似乎尚未意识到孤儿药其实是块“肥肉”,除了其高昂的价格以及不可替代性所带来的利益,它还会产生一些“额外”的好处。比如肉毒杆菌毒素最初其实是一种罕见病药,用于治疗罕见的眼部和颈部痉挛,而不久之后它因消除皱纹而闻名,如今它的适应症还包括了慢性偏头痛、原发性腋窝多汗症、神经病变导致的尿失禁等非罕见病。肉毒杆菌毒素成了一种畅销药品,也使研发它的爱力根公司(Allergan)获得了源源不断的“意外之财”。 同样的道理,罕见病药物对于一般病人和医生都同样有益。张宏冰教授解释道,“因为罕见病症状非常明显,在基因层面上比较容易识别,其因果相当于1+1=2的公式。而我们患上的其他普通病,虽有些复杂得像微积分,但它们总归是以1+1=2这些公式为基础的。”例如,对罕见病结节性硬化症的研究成果,将对多种肿瘤疾病(包括癌症)成病机理的研究发挥极大作用,进而大幅改进肿瘤疾病的治疗效果。 当下正迅速发展的“精准医疗”,也是将本来用于罕见病治疗的原理和方法应用到非罕见病的治疗中。精准医疗可以根据患者的基因型、基因表达和临床表现来针对性地选择药物、治疗方式,这原本多应用于罕见病的治疗,但因为常规病症都可以在基因上找到根源,所以这种方法也逐渐被用到非罕见病的治疗上,即针对基因的问题来准确用药。 对罕见病的研究,不仅是令罕见病患者受益的事,它也会为整个人类的医疗发展提供重要参考。 他们就是我们,我们也是他们。