2024年9月6日,在第十三届中国罕见病高峰论坛开幕式上,《时不我待:中国罕见病立法研究报告》研究成果正式发布,该报告在国内第一次全面梳理和论证了中国罕见病立法工作的必要性和可行性、立法方向和意义、立法目标和路径,为罕见病患者的法律权益保障发声呐喊,同时结合国际经验和中国多年实践经验,希望给立法工作者、政策制定者和研究者提供一份翔实的案头资料,以加速推动罕见病立法工作的实现。


即日起,罕见病信息网将对该报告进行系统性连载,本篇章为连载三,敬请关注后续更新其余。
已发布篇章如下:
当下,就是推动中国罕见病立法的最佳时机
时不我待:中国罕见病立法调研报告 | 连载二
第一章 时不我待一中国罕见病立法的必要性和紧迫性
第三节 罕见病产业巨大潜力待释放,立法是推动其乃至整个生物医药产业弯道超车的关键
罕见病市场理论潜力巨大
罕见病是继传染病、肿瘤之后的又一全球健康挑战。由欧洲罕见病组织 (EURORDIS) 于2008年2月29日发起并组织的“国际罕见病日”,其2020年的主题是“全球三亿,并不罕见”, 指出全球约有3亿人受到罕见病的影响(并非患病人数)。
罕见病也是全球新药研发的热土。按照美国或欧洲的“孤儿药认定”来统计,最近五年中,欧美每年批准的新药,超过半数为孤儿药。2022年,美国食品与药品监督管理局 (FDA) 总共批准上市了37个新药,其中21个是孤儿药,占比近六成,这21个孤儿药中又有一半是非肿瘤相关的罕见病用药。2022年,欧洲药品管理局 (EMA) 批准了49个新分子实体,其中22个是孤儿药,占比也高达45%。2022年全球药品销售额排名前100的药品中,超过三分之一是孤儿药。此外,大型制药公司近年来在罕见病领域频繁出手,产品交易、兼并购交易持续活跃,也说明了罕见病在新药布局中的重要性。历史上,赛诺菲以201亿美元的交易额并购了聚焦罕见病药物开发和商业化的健赞公司,之后大型并购屡屡见报,如武田公司以650亿美元收购夏尔公司、阿斯利康以390亿美元收购亚力兄公司等。
Evaluate Pharma预测,全球孤儿药市场将从2020年的604亿美元增长到2030年的1,889亿美元,这个数字还未包含针对罕见病肿瘤的孤儿药。
我国罕见病产业发展迟滞,尚未形成规模
然而,比欧美市场,我国罕见病产业发展较晚,仍处于起步阶段,目前尚未形成一定的规模。 从狭义的医药产业来看,目前仍以进口为主,本土创新极其缺乏。根据蔻德罕见病中心整理的数据,以卫健委等部委颁布的两批罕见病目录为界定依据,我国已获批上市的罕见病药品约252种(非新分子实体,包含仿制药),这其中,接近六成为进口药。在147种进口药中, 近九成为原研创新药,只有极个别为进口仿制药。而在105种国产药品中,绝大多数为仿制药或生物类似药,只有1个改良新药、5个1.1类创新药。
从市场需求来看,我国罕见病患者仍存在巨大的未满足需求,目前我国在罕见病领域最突出的矛盾之一,仍是药品的可及性问题:
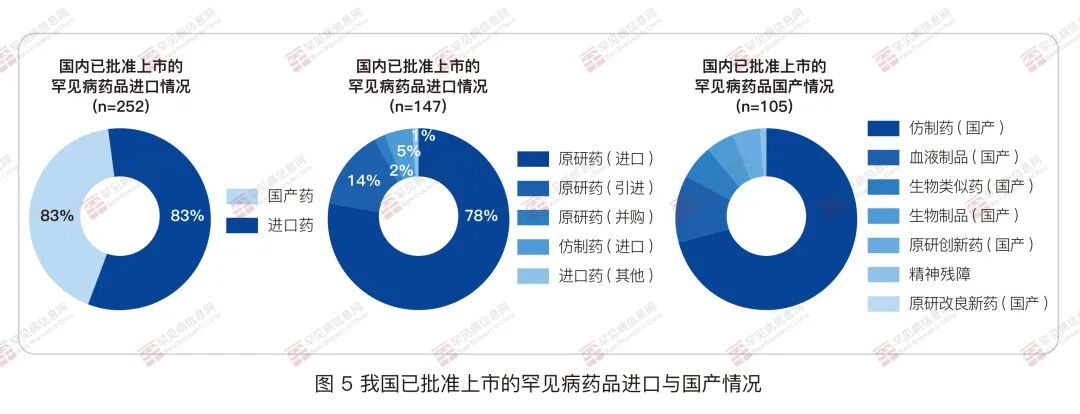
首先,全球已获批上市罕见病药物有超过800种(新分子实体/新剂型),然而只有不到30% 的药物在我国获批上市。 按照国家卫健委等部门发布的《第一批罕见病目录》和《第二批罕见病目录》为界定依据,目录内70%的罕见病在我国都缺乏已批准上市的有效疗法,其中有33种罕见病,患者面临“境外有药、境内无药”的困境。针对全球无药的罕见病,我国在研发新药上,也缺乏系统性的政策支持,国内有意愿做罕见病新药研发的屈指可数。绝大多数的 罕见病救命药仍未能进入中国市场。
其次,虽有三分之二的罕见病药品已被纳入国家医保目录,但绝大多数为“老药”“老分子”,因其有罕见病适应症而被记入,罕见病特效药被纳入医保的仍是少数。罕见病高值药物(年治疗费用超过30万元)的保障问题仍面临系统性的障碍。近年来,多个高值罕见病药品,因价格问题直接“放弃申报”国家医保谈判。主动申报通过形式审查的高值药,也多因价格因素无缘谈判。
最后,已上市的罕见病药品中,来自我国本土自主创新的占比极低,在105种国产药品中,绝大多数为仿制药或生物类似药,只有1个改良新药、5个1.1类创新药。稍微延伸去看,国产仿制药上市后,也并未能解决我国患者的支付难题,价格普遍是原研药品的60%以上,甚至多个产品价格超过原研的80%。2023年热议的氢化可的松片涨价十倍,正是其中一个缩影。
而在更为广义的产业概念里,罕见病产业还应包含器械、疫苗、特医食品、罕见病互联网诊疗、康复服务、商业保险等等。然而,这些都因为缺乏系统性的政策支持,而尚未得到关注和发展 。
我国罕见病产业发展面临系统性挑战
我国罕见病尚未形成产业化发展格局,背后存在几项关键性系统性挑战或缺失:缺乏国家层面的“罕见病”及“罕见病药物”界定体系、缺乏更为系统的罕见病新药研发激励机制、尚未建立可持续的创新支付体系,以及罕见病产业发展顶层设计的缺失。
缺乏国家层面的“罕见病”及“罕见病药物”界定体系
我国目前尚没有针对罕见病的立法或定义,政府目前选择使用“目录制”对罕见病进行界定。 2016年,在第五届中国罕见病高峰论坛上,蔻德罕见病中心 (CORD) 特别发布了《中国罕见病参考名录》,在当时引起了整个行业广泛的讨论,为国家的罕见病定义工作提供了一个重要发展方向。在这一民间努力的推动下,2018年5月,国家卫生健康委员会、科学技术部、工业和信息化部、国家药品监督管理局、国家中医药管理局五部门联合公布《第一批罕见病目 录》,收录了121种罕见病。这是中国政府首次以疾病目录的形式界定何为罕见病。
历史上,民间团体多次尝试以发病率的阈值界定罕见病。2010年5月17日,中华医学会医学遗传学分会在上海举办的中国罕见病定义专家研讨会上,与会专家建议将中国的罕见病定义为患病率小于1/500,000或新生儿发病率小于1/10,000的疾病。据此估算,中国罕见病患者人数约为 1,680万。2021年9月11日,《中国罕见病定义研究报告2021》提出“新生儿发病率小于1/万、 患病率小于1/万、患病人数小于14万的疾病”为罕见病。然而这些定义都未能获得广泛共识。
然而,以患病率/发病率界定罕见病,在我国有诸多挑战,并不适合当下的国情:
首先,罕见病的界定,绝不仅仅是医学定义,而是社会定义,是为了制定政策向有需要的群体倾斜资源,做“二次分配”服务的。罕见病,从全球来看,是指发病率很低、很少见的疾病,一般为慢性、严重的疾病,常常危及生命。罕见病并非特指某种疾病,而是对一大类散落在各个疾病系统的罕见疾病的统称。
罕见病本质上是一种社会定义,是一个相对概念,在时间的维度里是可变的可被重新定义的社会认知。随着人类对疾病的研究逐渐深入,有些罕见病可能会成为常见病,每年也都有新的罕见病例被报道。所以,在全球层 面,并没有一个统一且被普遍接受的对罕见病的定义。并不是所有国家和地区都选择使用患病率/发病率作为对罕见病的定义,各国家或地区的选择本质上是一种政策工具选择。
其次,随着基因检测技术的发展和对精准医疗需求的与日俱增,人类疾病正不断被重新定义,罕见病的流行病学边界将越来越充满争议。按组织学分型的方法,将逐步让位于按基因突变和靶点划分的方法。
在肿瘤领域,疾病的重新定义和“罕见病化”已经日益突出。在传统组织学分型所定义的肺癌,在未来迭代越来越快的诊断技术下,会被重新分拆定义为几十甚至上百种不同基因突变的肺癌,如ALK+肺癌、EGFR+肺癌、NTRK+肺癌、RET+ 肺癌等,这些分型的发病率都极低,都是不折不扣的“罕见病”,然而我们对罕见病的定义 是否要接纳它们?
最后,在绝大部分罕见疾病上,我国都缺乏流行病学研究,因此围绕发病率/患病率的讨论极具挑战。
缺乏更为系统的罕见病新药研发激励机制
首先,保护罕见病新药研发的创新驱动力,需要特殊的专利补偿、数据保护和市场独占等机制,我国亟待落地实施一系列新政。2017年,《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》提出,创新药且属于罕见病用药、儿童专用药的给予10年数据保护期,改良型新药的罕见病用药、儿童专用药,给予3年数据保护期。
2018年,《药品试验数据保护实施办法(暂行) (征求意见稿)》62提出对罕见病用药或儿童专用药自该适应症首次在中国获批之日起给予6年数据保护期,但该办法至今未能正式落地。四年后的2022年,《中华人民共和国药品管理法实施条例(修订草案征求意见稿)》59提出给予罕见病新药不超过7年的市场独占期,与海外最高10年的市场独占期仍有差距,但目前尚未正式落地。
核心政策迟迟未能正式落地,这其中又与我国创新药面临的问题交织在一起,一环未解,一环 又结。其中一个最大的不确定是,我国在监管层面对“创新药”的界定,仍未有普遍共识,创新 到底是指“中国新”还是“全球新”?而对“罕见病”的界定尚未落槌,如何界定“罕见病新药”?
其次,我国对罕见病改良新药、仿制药的监管亟需变革。 一方面,罕见病中,80%以上为遗传性疾病,多于儿童期起病,因此儿童用药是罕见病用药中极其重要的部分,而对已有药物的改良和适应症扩展,正是全球罕见病研发和创新的重要路径之一。欧美每年新批准的罕见病药品中都有相当大的比例是505b2类新药,也就是我国的2类药。然而在我国,受肿瘤新药研发“去泡沫” 的影响,做2类罕见病新药研发的难度不亚于做1.1类新药。另一方面,针对罕见病仿制药,我国也缺乏相应的激励政策。从欧美市场购买原研参照药,花费高昂,本身已经构成了极高的准入门槛,再加之缺乏针对性的激励政策,我国企业仿制罕见病药品的动力严重不足。
最后,与第一个系统性挑战,缺乏罕见病界定相呼应,解决新药研发激励不足,应考虑建立罕见 病药品评价机制或孤儿药认定机制。并在此基础上,参考美国建立基于孤儿药认定的优先审评券激励机制,在无需直接消耗政府资源的情况下,“借花献佛”,以优先审评券的市场交易,形成大企业向创新型企业“转移支付”,起到激励企业研发罕见病药物的作用。
尚未建立可持续的创新支付体系
支付制度的缺失,严重影响了我国罕见病患者的用药可及,同时也制约了产业的形成和发展。 针对罕见病药物的支付,如果不能形成可持续的正向激励,企业的研发积极性就难以调动,新药供给就越来越少,最终难以满足患者用药需求。
首先,我国现有基本医疗保险并未给与罕见病患者和药物“同等保障待遇”(各地报销比例:50~65%,个人年度报销封顶线:18~35万元/年)。多种罕见病存在唯一用药,但因价格问 题,难以突破医保谈判门槛对药品治疗费用“50万元/年不谈,30万元/年以上不进”的限制, 无法被纳入医保,导致患者陷入用药可及极差的困境。
其次,基本医疗保险对罕见病支付的缺位,导致多层次保障在现实中难以落地。我国现有的多层次保障体系中,如果狭义上的基本医疗保险(以药物是否纳入国家医保目录为标志)未启动,没有纳入某种罕见病药物,该药物也无法获得大病保险和医疗救助的支付。在地方上盛 行的商业保险如“惠民保”,大多也以基本医疗保险为参考决定报销待遇。在现行保障制度下, 如果政府的基本医疗保险没有行动,很难带动广义上的多层次保障的发展,大病保险、医疗救 助或商保等,就只是空中楼阁。
最后,在国家层面尚未形成系统性解决办法时,一部分有能力探索罕见病支付保障的区域被限制了发展。“医保待遇清单制”在实践中极大地约束了地方的探索,让《中共中央国务院关于深化医疗保障制度改革的意见》中对“探索罕见病用药保障机制”的路径无法落地。
因此,在系统性支付体系缺位时,罕见病产业,无论是药械领域,还是诊疗康复服务领域,都难以有较大的发展。
罕见病产业发展顶层设计的缺失
我国目前针对罕见病的产业发展,缺乏顶层设计。 一方面,与罕见病产业发展相关的政策,多为散落在药品监管、卫生、医保等各个部委的分散决策,政策之间缺乏协调和一致行动,难以形成合力,甚至多有冲突。如对罕见病、罕见疾病、罕见病药物的界定,部委之间缺乏共识。 另一方面,在罕见病发展上,央地分工较为模糊。地方先行探索的边界不清晰,缺乏政策发展稳定性和可持续性。顶层设计的缺失,导致各部委、各地方对罕见病领域的政策制定,始终持 “观望”态度,已经出台的政策既缺乏价值统领,又没有可持续性,最终对患者问题的解决,对 产业的发展,都无法起到稳定预期或激励作用。
罕见病产业发展有望带动整个生物医药领域的弯道超车 ,具有重大国家战略意义
罕见病是人类疾病的缩影,是解码人类健康奥秘的钥匙和突破口,是促进人类医学科学研究发展的重要线索。关注罕见病发展问题,意味着我们在人类永无止境地探究医学科学奥秘的道路上,拿起了一把钥匙,有望帮助我国的医药医疗产业界另辟蹊径,促进我国生物医药产 业迈向全球价值链中高端,培育世界级先进研发乃至制造业集群,实现在全球市场的弯道超车。习近平总书记在党的十九大报告中指出:“创新是引领发展的第一动力,是建设现代化经 济体系的战略支撑。要瞄准世界科技前沿,强化基础研究,实现前瞻性基础研究、引领性原创成果重大突破。”
在全球步入精准医疗的时代,罕见病极有可能成为我国突破生物产业创新的切入点:
一方面,罕见病是全球共同面临的挑战,存在巨大的未满足需求,全球已知的7,000多种罕见病中,仅有不到10%有治疗方案,仍有大批的空白领域需要突破,为中国的生物医药创新留下了巨大的空间。
一方面,80%的罕见病是由于基因缺陷包括单基因突变所导致的遗传病,在精准医疗的时代,随着基因检测和基因疗法的快速发展,针对罕见病的药物研发较为容易获得成功,在罕见病领域实现治愈型疗法的全球突破,对我国生物药行业发展来说是能够主动把握的“弯道超车”的机会。
在过去数十年市场需求和投资的驱动下,我国在常见病和肿瘤等领域的药物研发竞争已渐趋白热化,国内新兴生物药企业已经越来越难以在这些疾病领域寻找到真正的全球创新突破口,只能扎堆于“Fast follower (快速跟进模仿)”的药物研发,而在罕见病领域的研究有望带动我国的生物医药产业“弯道超车”走向全球创新的舞台。
另一方面,以罕见病为研发突破点,有望在不同的疾病队列上拓展研发出一批优秀的创新药物,带动我国在各个疾病领域迎头赶上,产生出一批优秀的药物和研发创新企业。 罕见病, 不是特指某一种疾病,而是对一大类散落在各个疾病系统的罕见疾病的统称。每一种疾病, 在发现之初,都可能是一种罕见疾病。每种常见疾病的背后,都站着一条隐形的罕见疾病队列,而每种罕见疾病的背后,也有一条隐形的常见疾病队列。
因此,集中精力研究一种罕见病,厘清代谢路径,有利于促进在一整个相关疾病队列上的特效药物研发。过去十年欧美生物制药企业的崛起,为我们提供了绝佳的参考样本,全球销量排名前十的生物药几乎都是以 “孤儿药”身份最早在欧美市场获批上市进而逐步拓展了在多个疾病适应症的应用,成为全球医药经济的领头者。美国和欧盟每年批准上市的新药中已经有超过半数以上是“孤儿药”,而 未来即将进入全球市场的一大批创新生物药也多是新兴生物制药企业针对罕见靶点研发的“孤儿药”。
最后,在罕见病产业创新的赛道上,我国甚至还有更强的资源禀赋。 中国作为世界人口大国和第二大经济体,有最大的罕见病患者群体,能为科研和临床研究提供巨大的样本基础,有机会为中国患者也是为全世界的罕见病患者寻找医疗解决方案。
从全球生物医药产业的进程来看,中国近年来在生命科学基础研究、基因诊断技术及生物医药领域的投入不断加大,具备了相对雄厚的技术基础,有极强的资源禀赋以罕见病为切入点,在罕见病研究和药物研发领域实现“弯道超车”,促进我国生物医药产业迈向全球价值链中高端,培育世界级先进研发乃至制造业集群,引领全球医疗健康创新。
更进一步看,中国的生物医药行业也是以进口为主。数据显示,2023年医药商品进口额居高 不下达933亿美元⁹,显示出中国对海外医药工业的依赖性,在国际关系不确定性越发增强的当下,存在一定的供应链安全风险。
与此同时,美国试图通过《生物安全法案》压制我国的生物医药基础设施和产业发展,把自身的安全建立在他国的不安全基础上,不得不让我们警惕被“卡脖子”的风险。因此,通过对罕见病产业的扶持,撬动整个中国生物医药行业的研发和创新,具有重要的战略意义。
展望未来,我们迫切需要通过罕见病领域的立法,激励罕见病领域的研发与创新,同时也带动整个生物医药行业的跨越式发展,保障中国的生物安全和人民健康之外,更能够为全球健康产业发展做出中国贡献。


上述案例充分说明,在中国推动罕见病立法能够同时推动产业现代化发展。促进生物医药产业的现代化发展,不但有助于占据全球竞争制高点,成为科技强国,更是稳固中国生物医药 供应链,保障中国患者用药安全的必要举措。
重磅报告 报告获取
《时不我待:中国罕见病立法调研报告》请通过下面二维码获取,也欢迎罕见病行业从业者、媒体记者、患者家庭、政府部门能将本报告传阅给更多政策推动者。期待更多读者对报告提出批评建议!

义卖价:29元
费用仅包含设计/印刷/邮寄等成本费。