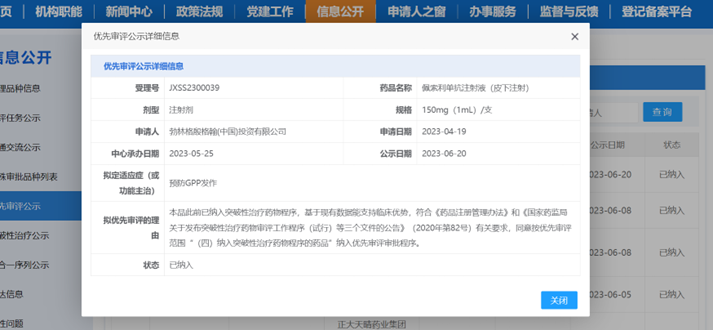
6月29日,勃林格殷格翰宣布中国国家药品监督管理局药品审评中心(CDE)正式授予其罕见皮肤病创新靶向生物制剂圣利卓®(通用名:佩索利单抗注射液)用于预防泛发性脓疱型银屑病(Generalized Pustular Psoriasis,GPP)发作新增适应症优先审评审批资格。据悉,该拟定新适应症于5月11日全球率先在华递交上市申请,早于欧美日,开创了行业先河!
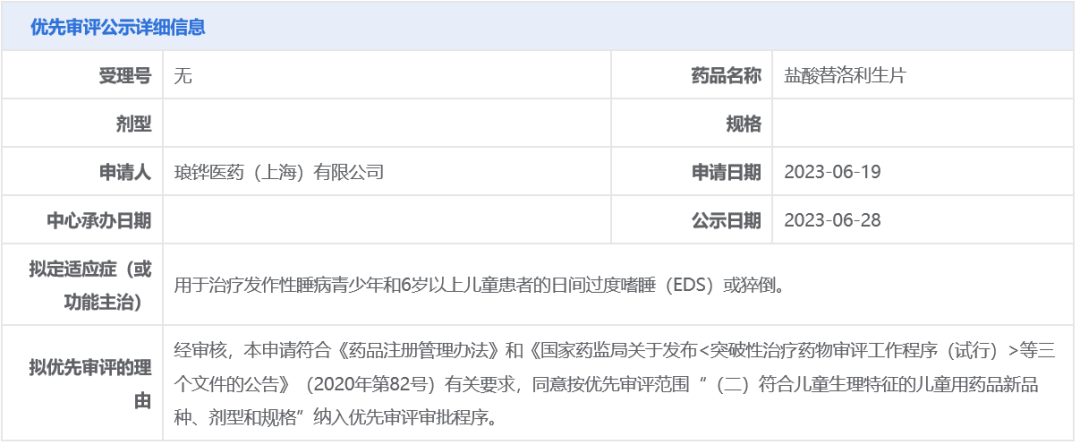
2 昨日(6月28日),中国国家药监局药品审评中心(CDE)官网最新公示,琅铧医药申请的盐酸替洛利生片以“符合儿童生理特征的儿童用药品新品种、剂型和规格”为由拟纳入优先审评,针对适应症为:用于治疗发作性睡病青少年和6岁以上儿童患者的日间过度嗜睡或猝倒。替洛利生是⼀种选择性组胺H3受体反向激动剂,在欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA)分别获得了孤儿药认定,并且被 FDA 认定为突破性治疗药物。该药物已于2021年9月向中国药品监督管理局递交用于治疗发作性睡病的新药上市申请(NDA)。琅铧医药拥有该药在中国的独家权益。 参考资料: 1、https://mp.weixin.qq.com/s/L-MT2R2opJdXDfOVDOIu-g 2、https://mp.weixin.qq.com/s/1bIUUO0MMPvN_SUJIMESOQ