7月6日,国家药品监督管理局药品审评中心(CDE)发布了关于公开征求《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》意见的通知。意见稿提出,在研发立题阶段,主要是获取患者实际需求、患者当前治疗经验(如适用)、对获益-风险权衡的信息以及明确研发计划的可行性,特别是罕见病用药、创新药的研发。
蔻德罕见病中心高级顾问肖磊表示,患者在药物研发全生命周期的参与不仅有助于提高研发质量和成功率,亦有利于平衡投资风险与回报。CDE的指导原则在鼓励患者参与药物研发进程中迈出了重要一步,呼吁各患者组织积极参与征求意见稿的意见反馈,积极为患者发声建言献策。
2019年9月,蔻德曾在第八届中国罕见病高峰论坛上发布《患者社群组织如何推动药物研发——全球经验》报告,该报告通过研究分析我国罕见病患者组织参与促进药物研发的现状,结合全球经验,为推动我国患者组织与科研人员及医药产业界在药物研发方面建立合作提供了一份详实、严谨、客观的指导参考意见。
关于公开征求《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》意见的通知
发布日期:20220706
申办者基于何种原则、如何开展组织患者参与到药物研发工作中,从而获得患者体验信息和数据,是药物研发的关键要素。我国尚无此类指导原则出台,为便于申办者开展相关组织工作,我中心起草了《组织患者参与药物研发的一般考虑指导原则》,经中心内部讨论,已形成征求意见稿。 我们诚挚地欢迎社会各界对征求意见稿提出宝贵意见和建议,并及时反馈给我们,以便后续完善。征求意见时限为自发布之日起1个月。 您的反馈意见请发到以下联系人的邮箱: 联系人:王洪航、王晶 联系方式:85243050、85243063 感谢您的参与和大力支持。
附 件 1 《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》




















附 件 2 《组织患者参与药物研发的一般考虑指导原则(征求意见稿)》起草说明


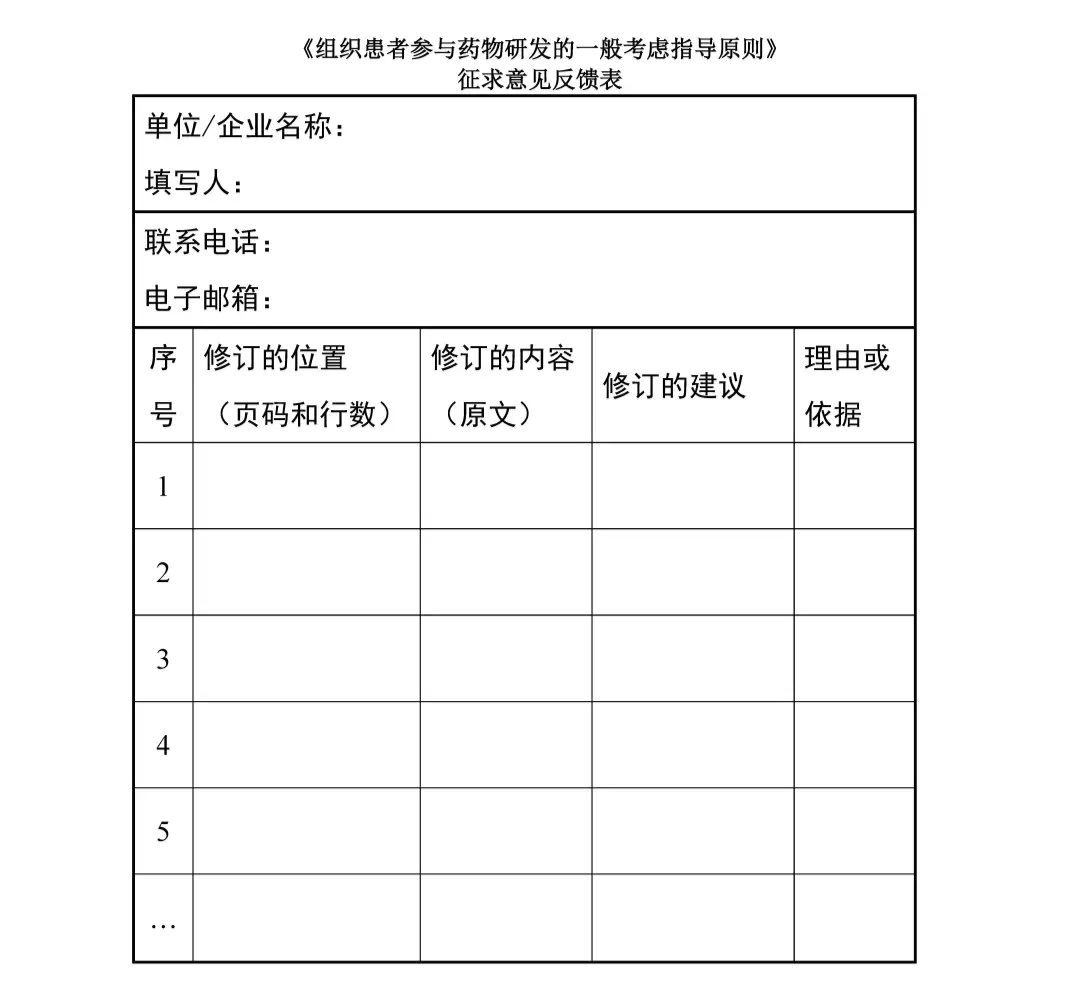
附 件 3 征求意见反馈表