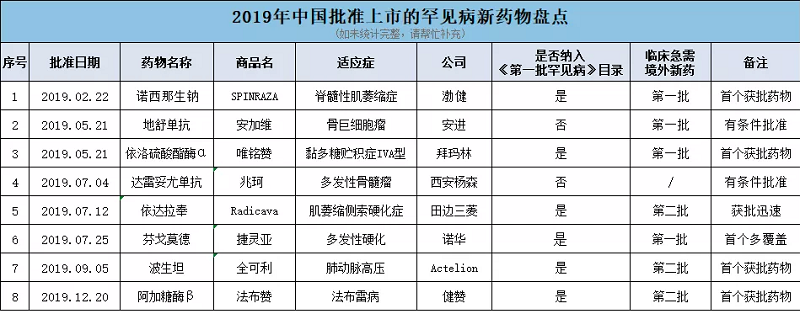
近两年我国越发重视罕见病诊治,相继出台多项政策试图缩小与国外用药可及性的差距。尤其是《第一批罕见病目录》和《临床急需境外新药名单》两项举措,意义重大。前者以目录形式界定了第一批罕见病,后者则以此为基础纳入大量境外已上市罕见病药物,并根据国家药监局《临床急需境外新药审评审批工作程序》的要求,建立专门通道加快审评审批。效果可谓立竿见影!
截止12月20日,2019年我国新批准8款罕见病药物,数量之多,审批速度之快,都是空前的。今年获批的这些药物用于治疗8种罕见病,其中6种为《第一批罕见病目录》所收录疾病。获批药物中有4款为国内首个批准药物,7款为《临床急需境外新药名单》药物。
脊髓性肌萎缩症-诺西那生纳
脊髓性肌萎缩症 (Spinal Muscular Atrophy, SMA)是一种罕见的遗传性神经肌肉疾病,以脊髓和下脑干中运动神经元的丢失为特征,从而导致严重的、进行性肌肉萎缩和无力。最终,SMA患者可能丧失行走能力,并且难以完成呼吸和吞咽等基本生活功能,需要重大的医疗干预和护理帮助。如果不进行治疗,大多数患有最严重类型SMA的婴儿在没有呼吸干预的情况下,无法活到两岁。2019年2月22日,诺西那生钠注射液(美国及欧盟注册商品名SPINRAZA)正式获得国家药品监督管理局批准,用于治疗SMA。诺西那生钠注射液是在中国首个获批治疗SMA的药物。
骨巨细胞瘤-地舒单抗
骨巨细胞瘤是一种极为罕见且进展迅速、富含人核因子活化因子受体配体(RANKL)的原发性骨肿瘤,表现为在长骨的干骺端和骺部或脊柱、骶骨的偏心融骨性病变。病变表现为高度血管化和侵袭性融骨性病变,并且边界模糊以及过渡区较宽。表达RANKL的单核基质细胞是骨巨细胞瘤病变的肿瘤组分,基于目前的假说,其作用是募集破骨细胞样巨细胞,引起肿瘤具有侵袭性的溶骨活性。2019年5月21日,国家药品监督管理局有条件批准地舒单抗注射液(Denosumab Injection)进口注册申请,用于骨巨细胞瘤不可手术切除或者手术切除可能导致严重功能障碍的成人和骨骼发育成熟的青少年患者治疗。
黏多糖贮积症 IVA型-唯铭赞
黏多糖贮积症IVA型是一种罕见的遗传疾病,由于体内降解糖胺聚糖(GAG)的溶酶体酶N-乙酰半乳糖胺-6-硫酸酯酶(GALNS)缺失或活性不足,造成GAG及其代谢物硫酸角质素(KS)和6-硫酸软骨素在多器官和组织内逐渐贮积,进而导致器官功能减退。最常见特征为进展性骨骼发育不良、频繁手术以及活动能力、呼吸功能受限和早期死亡。2019年5月21日,唯铭赞获国家药品监督管理局上市批准,用于治疗黏多糖贮积症IVA型(MPS IVA)患者。唯铭赞是中国首个黏多糖贮积症药物,也是我国第一批《临床急需境外新药名单》里的品种。
多发性骨髓瘤-达雷妥尤单抗
多发性骨髓瘤(Multiple myeloma,MM)是浆细胞恶性增殖性疾病,疾病特征是骨髓中的浆细胞像肿瘤细胞一样无限制地增生,并且大部分病例伴有单克隆免疫球蛋白分泌,最终导致器官或组织损伤。2019年7月4日,国家药品监督管理局有条件批准达雷妥尤单抗注射液(英文名:Daratumumab Injection)进口注册申请,用于单药治疗复发和难治性多发性骨髓瘤成年患者,包括既往接受过一种蛋白酶体抑制剂和一种免疫调节剂且最后一次治疗时出现疾病进展的患者。
肌萎缩侧索硬化症-依达拉奉
肌萎缩侧索硬化症(ALS,也被称为“渐冻人症”)是一种罕见的神经退行性疾病,可导致整个身体的运动神经元逐渐破坏和肌肉萎缩,中国大约有20,000-30,000名ALS患者。2019年7月25日,由田边三菱制药研发(北京)有限公司提交的ALS药物依达拉奉(edaravone)上市申请已获得国家药品监督管理局批准。值得注意的是,该药从获得优先审评到获批只用了不到两个月的时间。
多发性硬化症-捷灵亚®
多发性硬化症(MS)是一种严重、终身、进行性、致残性的中枢神经系统脱髓鞘疾病,好发于20-40岁的中青年人群。2019年7月12日,捷灵亚®(芬戈莫德)在中国正式获批用于治疗10岁或10岁以上患者的复发型多发性硬化 (RMS)。捷灵亚® (芬戈莫德)是第一种,也是唯一一种同时覆盖多发性硬化儿童、青年和成人患者的疾病修正治疗方法。
肺动脉高压-全可利®
肺动脉高压是一种慢性、危及生命的疾病,肺动脉压力会显著升高,继而导致右心衰竭和严重的运动耐量下降,严重者会导致患者死亡。2019年9月5日,波生坦分散片(全可利®)(规格:32mg)获得国家药品监督管理局批准用于治疗儿童肺动脉高压(PAH)。波生坦分散片(全可利®)由此成为国内首个获批的儿童肺动脉高压患者用药。
法布雷病-法布赞®
法布雷病是由X连锁基因缺陷造成的一种先天性代谢疾病,表现为患者体内α-半乳糖苷酶A活性明显降低或缺失,导致鞘糖脂在多种组织细胞的溶酶体中病理性蓄积。该病始发于胎儿并伴随患者终身逐步恶化,引起心、肾等重要器官的衰竭。作为国内首个获批的法布雷病特效药,法布赞®填补了国内特异性治疗药物的空白和临床未被满足的需求,可长期稳定肾功能、减轻疼痛、改善患者生存质量,使患者回归正常生活成为可能。
目前全球已知有超过7000种罕见病。由于发病率低,患者少,市场需求小,药物研发周期和成本较高,长期以来罕见病药物研究进展缓慢,国产药物更是少之又少;在这种情况下,引进境外已获批新药,成了最快、最直接的解决国内患者未满足需求的手段。
目前国家药品监督管理局药品审评中心共发布了2批临床急需境外新药名单,共包括66个新药,其中41个属于罕见病用药或与罕见病有关,目前10个已经获得批准(2018年批准3个)。从趋势看,得益于国家政策红利,我国罕见病药物迎来了历史性机遇,预计未来几年会有大量药物获得批准,2020年值得期待!