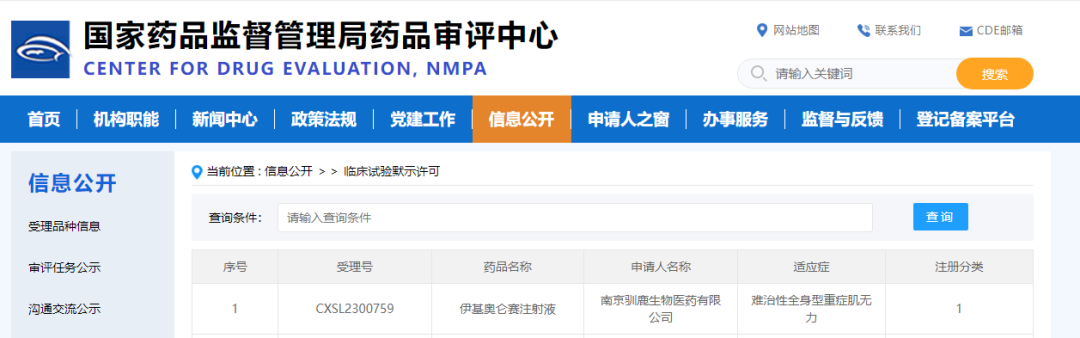
2024年1月25日,驯鹿生物宣布国家药品监督管理局(NMPA)审评中心(CDE)已正式审批通过其全人源靶向BCMA嵌合抗原受体自体T细胞注射液(伊基奥仑赛注射液,研发代号CT103A)新增扩展适应症难治性全身型重症肌无力(Myastheniagravis,MG)的临床试验申请(IND)(受理号:CXSL2300759)。
伊基奥仑赛注射液(商品名:福可苏®)已于2023年6月30日获国家药监局批准上市,用于治疗复发难治多发性骨髓瘤,本次重症肌无力IND的获批进一步拓展了伊基奥仑赛注射液的适应症范围,这也是其继视神经脊髓炎谱系疾病(NMOSD)后获批IND的第二个自免领域适应症。驯鹿生物是国内率先将CAR-T产品用于自免适应症的公司,有望改变自免疾病的治疗格局。
重症肌无力(myasthenia gravis,MG)是一种由自身抗体介导的神经肌肉接头传递障碍疾病,MG的主要临床表现为局部或全身肌肉的肌力下降,可累及眼肌、呼吸肌、四肢肌等重要肌群,对患者的生活质量产生巨大的负面影响,而且肌无力危象导致的吞咽或呼吸困难会危及生命。MG的主要致病抗体包括 AChR、MuSK 及 LRP4抗体, 极少部分患者血清无上述可检测到的抗体,称为抗体阴性 MG。MG可发生于任何年龄段,女性略多于男性。根据相关研究,2022年中国MG的发病人数约为9600人,患病人数约为28.2万人。目前国内治疗MG的药物多为激素或非激素免疫抑制剂,但是现有疗法只能起到缓解效果,在疾病控制、长期安全性等方面均存在不足。
驯鹿生物创始人及首席执行官张金华女士表示:“长期以来,全身型重症肌无力患者的治疗依靠专家经验判断和传统治疗方案为主,现有药物疗法并非对所有患者都有效,临床上有10%-15%的MG患者存在难治性疾病4,这些难治性MG患者和潜在发展为危象的患者的治疗,是临床上面临的重要挑战,急需安全有效的创新治疗来解决这些问题。在我们的IIT研究中,很高兴地看到伊基奥仑赛注射液可以阻止疾病进展,并表现出逆转疾病的早期征象,有望改变MG治疗格局。驯鹿生物会尽快启动和完成临床试验,为中国重症肌无力患者带来治愈的希望。”
关于驯鹿生物
驯鹿生物是一家致力于细胞创新药物研发、生产和销售的生物制药公司。公司以开发血液肿瘤细胞类药物和抗体药物为创新基石,向自身免疫疾病拓展,拥有完整的从早期发现、临床开发、注册申报到商业化生产的全流程能力。
公司现有10余个处于不同研发阶段的创新药物品种,其中伊基奥仑赛注射液(全人源BCMA CAR-T产品)已获国家药监局(NMPA)批准上市,并已获得美国FDA批准注册临床,用于治疗复发/难治多发性骨髓瘤。
研发管线
